
科目: 来源: 题型:解答题
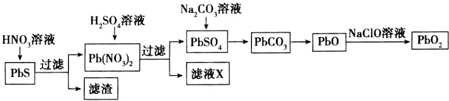
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Na2HPO3溶液显碱性,说明HPO32-的电离程度大于水解程度 | |
| B. | 25℃时,将0.1 mol•L-1的亚磷酸溶液加水稀释后,n(H+)与n(OH-)的乘积不变 | |
| C. | 利用H3PO3进行化学镀银,当参加反应的$\frac{n(A{g}^{+})}{n({H}_{3}P{O}_{3})}$=2时,氧化产物为H3PO4 | |
| D. | NaH2PO3溶液显酸性,其溶液中存在的粒子浓度关系:c(H2PO3-)>c(HPO32-)>c(H3PO3)>c(H+)>c(OH-) |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 使用含有氯化钠的融雪剂会加快桥梁的腐蚀 | |
| B. | “海水淡化”可以解决“淡水供应危机”,向海水中加入净水机明矾可以使海水淡化 | |
| C. | 煤经过气化、液化等物理变化可得到清洁燃料 | |
| D. | 棉花、羊毛、木材和草类的主要成分都是纤维素 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 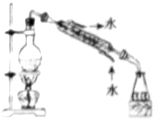 分离Na2CO3溶液和CH3COOC2H5 | B. |  实验室制取少量氨气 | ||
| C. | 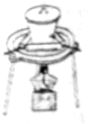 高温煅烧石灰石 | D. | 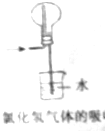 实验室吸收HCl气体 |
查看答案和解析>>
科目: 来源: 题型:填空题
 .
.查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 标况下11.2L乙烷分子中所含分子数为0.5NA | |
| B. | 1.8g的NH4+中含有的电子数为0.1NA | |
| C. | 20克氖气所含原子数为0.5NA | |
| D. | 常温常压下,48g O3和O2的混合气体中,含有氧原子数为3NA |
查看答案和解析>>
科目: 来源: 题型:解答题
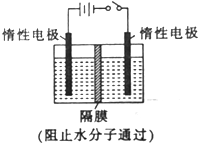 以NO2为原料可以制得新型绿色硝化剂N2O5,原理是先将NO2转化为N2O4,然后采用电解法制备N2O5,其装置如图所示.
以NO2为原料可以制得新型绿色硝化剂N2O5,原理是先将NO2转化为N2O4,然后采用电解法制备N2O5,其装置如图所示.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 0.5mol/L K2SO4溶液所含K+数目为NA | |
| B. | 标况下22.4L苯所含分子数目为NA | |
| C. | 56gFe与足量盐酸完全反应时,失去电子数目为NA | |
| D. | 常温常压下,16gO2和O3的混合气体所含原子数目为NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com