
科目: 来源: 题型:解答题
 研究金属铁及其化合物的性质有重要意义.
研究金属铁及其化合物的性质有重要意义.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 将1 mol MnO2加入足量浓盐酸中,加热 | |
| B. | 将l mol Na2O2加入足量水中, | |
| C. | 将1 mol Cu加入足量稀硝酸中,加热 | |
| D. | 将1 mol C加入足量浓硫酸中,加热 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 热稳定性:H2O>H2S>HF | |
| B. | 微粒X2-和Y2+的核外电子排布相同,离子半径:X2-<Y2+ | |
| C. | 第3周期金属都能与氯气发生化合反应 | |
| D. | 第IVA族元素的氧化物都能与NaOH溶液反应生成盐和水 |
查看答案和解析>>
科目: 来源: 题型:解答题
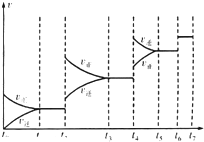 对碳硫及其化合物的研究有重要的意义.
对碳硫及其化合物的研究有重要的意义.| 实验编号 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| SO2 | O2 | SO2 | O2 | |||
| 1 | T1 | 4 | 2 | X | 0.8 | 6 |
| 2 | T2 | 4 | 2 | 0.4 | Y | t |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 元素X在周期表中的位置为第2周期VIA族 | |
| B. | 1 mol甲与足量的乙完全反应转移的电子数为6.02×1023 | |
| C. | 元素X、Y、Z的原子半径由大到小的顺序为r(Z)>r(Y)>r(x) | |
| D. | 1.0 L 0.1 mol•L-1戊溶液中阴离子的总物质的量小于0.1 mol |
查看答案和解析>>
科目: 来源: 题型:解答题
| 投料比[n(NO2)/n(CH4)] | 400K | 500K | 600K |
| 1 | 60% | 43% | 28% |
| 2 | 45% | 33% | 20% |
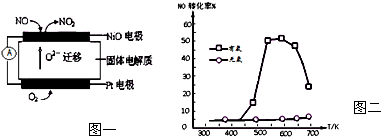
查看答案和解析>>
科目: 来源: 题型:选择题
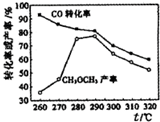 研究者在某条件下探究制备二甲醚反应:2CO(g)+4H2(g)?CH3 OCH3(g)+H2 O(g)△H,测定结果如图所示.下列判断错误的是( )
研究者在某条件下探究制备二甲醚反应:2CO(g)+4H2(g)?CH3 OCH3(g)+H2 O(g)△H,测定结果如图所示.下列判断错误的是( )| A. | △H<0 | |
| B. | 该反应伴随有副反应的发生 | |
| C. | 制备二甲醚的适宜温度为280~290℃ | |
| D. | 加入催化剂可以提高CH3 OCH3的产率 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 该溶液可由等体积、浓度均为0.1mol•L-1的醋酸和氨水反应得到 | |
| B. | CH3COONH4加人纯水中,水的电离程度不变 | |
| C. | 常温下,电离平衡常数K(CH3 COOH)=K(NH3•H2 O) | |
| D. | 该溶液中c(CH3 COO-)大于同浓度CH3 COONa溶液中的c(CH3 COO-) |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 单质Se在空气中燃烧可生成SeO2 | B. | Se的原子序数为24 | ||
| C. | 可形成Na2SeO3、Na2SeO4两种盐 | D. | H2S比H2Se稳定 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com