
科目: 来源: 题型:解答题
 CH3COOCH3+H2O.
CH3COOCH3+H2O.查看答案和解析>>
科目: 来源: 题型:解答题
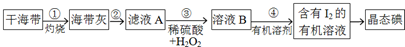
查看答案和解析>>
科目: 来源: 题型:解答题
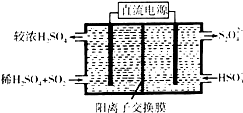 (1)利用Na2SO3溶液可脱除烟气中的SO2.Na2SO3可由NaOH溶液吸收SO2制得.NaOH溶液吸收SO2的过程中,pH随n(SO32-):n(HSO3-)变化关系如表:
(1)利用Na2SO3溶液可脱除烟气中的SO2.Na2SO3可由NaOH溶液吸收SO2制得.NaOH溶液吸收SO2的过程中,pH随n(SO32-):n(HSO3-)变化关系如表:| n(SO32-):n(HSO3-) | 91:9 | 1:1 | 9:91 |
| pH | 8.2 | 7.2 | 6.2 |
查看答案和解析>>
科目: 来源: 题型:选择题

| A. | 可使溴的四氯化碳溶液或酸性KMnO4溶液褪色 | |
| B. | 含有两种官能团 | |
| C. | 1mol该有机物与足量钠反应可得到0.5molH2 | |
| D. | 可以发生取代反应和加成反应,但不能发生聚合反应 |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 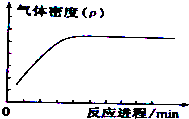 | B. |  | ||
| C. | 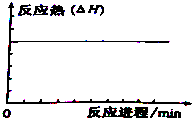 | D. |  |
查看答案和解析>>
科目: 来源: 题型:选择题
 某无色稀溶液X中,可能含有表所列离子中的某几种.
某无色稀溶液X中,可能含有表所列离子中的某几种.| 阴离子 | CO32-、SiO32-、AlO2-、Cl- |
| 阳离子 | Al3+、Fe3+、Mg2+、NH4+、Na+ |
| A. | 若Y是盐酸,则Oa段转化为沉淀的离子(表中,下同)只有AlO2- | |
| B. | 若Y是盐酸,则溶液中可能含有的阳离子是Al3+ | |
| C. | 若Y是NaOH溶液,则bc段反应的离子方程式为 Al(OH)3+OH-═AlO2-+2H2O | |
| D. | 若Y是NaOH溶液,则X溶液中只存四种离子是:Al3+、Fe3+、NH4+、Cl- |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
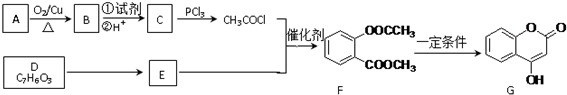
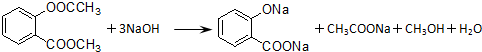 .
. .
.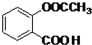 .
.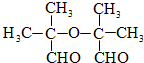 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com