
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 结构片段为 的高聚物,其单体是甲醛和苯酚 的高聚物,其单体是甲醛和苯酚 | |
| B. | 等质量的乙烯、乙醇、丙烯酸(CH2=CH-COOH)完全燃烧消耗氧气的量相等 | |
| C. | 由甘氨酸、丙氨酸形成的二肽有三种 | |
| D. | 石油的裂化、煤的汽化与液化都属于化学变化,而石油的分馏与煤的干馏都属于物理变化 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 可用铁作阳极材料 | |
| B. | 电解过程中阳极附近溶液的pH升高 | |
| C. | 阳极反应方程式为:2Cl--2e-═Cl2↑ | |
| D. | 1 mol二价镍全部转化为三价镍时,外电路中通过 了2 mol 电子 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 0.1mol•L-1的Na3PO4溶液中:c(Na+)=3c(PO43-)+2c(HPO42-)+c(H2PO4-) | |
| B. | 0.1mol•L-1的NaHS溶液中:c(H+)+c(H2S)=c(OH-)+c(S2-) | |
| C. | 0.1mol•L-1的氨水与0.1mol•L-1的NaHSO4溶液等体积混合:c(Na+ )=c(SO42-)=c(NH4+)>C(H+)>C(OH-) | |
| D. | 0.1mol•L-1的Na2CO3溶液与0.1mol•L-1的NaHCO3溶液等体积混合:c(Na+)>c(CO32-)>c(HCO3-)>c(OH-) |
查看答案和解析>>
科目: 来源: 题型:解答题
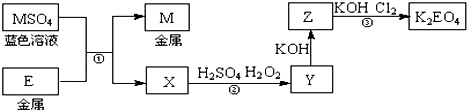
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 在0.1mol•L-1Na2C2O4溶液中:2c(Na+)=c(C2O42-)+c(HC2O4-)+c(H2C2O4) | |
| B. | 向10mL pH=12的NaOH溶液中滴加等体积pH=2的CH3COOH溶液:c(CH3COO-)>c(Na+)>c(OH-)>c(H+) | |
| C. | 浓度均为0.1 mol•L-1的小苏打溶液与烧碱溶液等体积混合:c(Na+)+c(H+)=2c(CO32-)+c(OH-)+c(HCO3-) | |
| D. | 浓度均为0.1 mol•L-1的硫酸氢铵溶液与氢氧化钠溶液等体积混合c(SO42-)=c(Na+)>c(NH4+)>c(H+)>c(OH-) |
查看答案和解析>>
科目: 来源: 题型:选择题
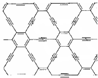 石墨炔是由1,3-二炔键与苯环形成的平面网状结构的全碳分子,具有优良的化学稳定性和半导体性能.下列关于石墨炔的说法不正确的是( )
石墨炔是由1,3-二炔键与苯环形成的平面网状结构的全碳分子,具有优良的化学稳定性和半导体性能.下列关于石墨炔的说法不正确的是( )| A. | 石墨炔属于芳香烃 | |
| B. | 石墨炔与金刚石互为同素异形体 | |
| C. | 石墨炔有望代替半导体材料硅在电子产品中得到广泛应用 | |
| D. | 石墨炔孔径略大于H2分子的直径,因此它是理想的H2提纯薄膜 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 用浓盐酸与二氧化锰共热制氯气 | |
| B. | 标准状况下,将1 g铝片投入20 mL 18 mol•L-1硫酸中 | |
| C. | 向100 mL 4 mol•L-1硝酸中加入5.6 g 铁 | |
| D. | 在5×107 Pa、500℃和铁触媒催化的条件下,用氮气和氢气合成氨 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
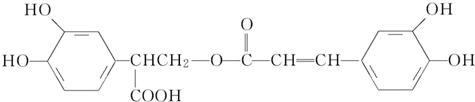 ,
,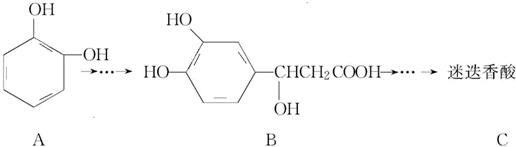
| A. | 有机物B可以发生取代、加成、消去、氧化反应 | |
| B. | 有机物A分子中所有原子一定在同一平面上 | |
| C. | 有机物C在浓硫酸催化下水解的一种产物是B | |
| D. | 1 mol B与足量的NaOH溶液反应,最多可消耗4 mol NaOH |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com