
科目: 来源:2016-2017学年河北石家庄辛集中学高二上阶段考一化学卷(解析版) 题型:选择题
分子式为C4H8Cl2的同分异构体有( )
A.3种 B.5种 C.8种 D.9种
查看答案和解析>>
科目: 来源: 题型:解答题
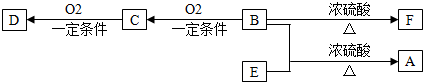
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | X2YZ3 | B. | X2YZ4 | C. | X3YZ4 | D. | X4Y2Y7 |
查看答案和解析>>
科目: 来源: 题型:解答题
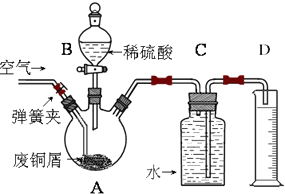 一学习小组利用下图所示装置,对某含少量Fe的废铜屑进行铜含量的测定,并探究利用其制备硫酸铜溶液.
一学习小组利用下图所示装置,对某含少量Fe的废铜屑进行铜含量的测定,并探究利用其制备硫酸铜溶液.查看答案和解析>>
科目: 来源: 题型:解答题
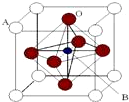 某钙钛型复合氧化物(如图),以A原子为晶胞的顶点,A位可以是Ca、Sr、Ba或Pb,当B位是V、Cr、Mn、Fe时,这种化合物的电阻率在有外磁场作用时较之无外磁场作用时存在巨大变化(巨磁电阻效应).
某钙钛型复合氧化物(如图),以A原子为晶胞的顶点,A位可以是Ca、Sr、Ba或Pb,当B位是V、Cr、Mn、Fe时,这种化合物的电阻率在有外磁场作用时较之无外磁场作用时存在巨大变化(巨磁电阻效应).| 碳酸盐 | CaCO3 | SrCO3 | BaCO3 |
| 热分解温度/℃ | 900 | 1172 | 1360 |
| 阳离子半径/pm | 99 | 112 | 135 |
查看答案和解析>>
科目: 来源: 题型:选择题
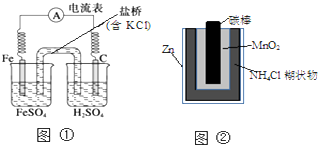
| A. | 图①中正极附近溶液pH降低 | |
| B. | 图②正极反应是2MnO2(s)+H2O(l)+2e-=Mn2O3(s)+2OH-(aq) | |
| C. | 图①中电子由Fe流向石墨,盐桥中的Cl-移向FeSO4溶液 | |
| D. | Zn-MnO2干电池自放电腐蚀主要是由MnO2的氧化作用引起的 |
查看答案和解析>>
科目: 来源: 题型:解答题
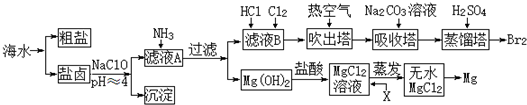
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:选择题
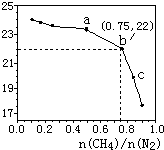 已知:在700℃的恒温、恒容密闭容器中发生反应3CH4(g)+2N2(g)?3C(s)+4NH3(g),若CH4与N2在不同投料比$\frac{n(C{H}_{4})}{n({N}_{2})}$时CH4的平衡转化率如图所示,下列说法正确的是( )
已知:在700℃的恒温、恒容密闭容器中发生反应3CH4(g)+2N2(g)?3C(s)+4NH3(g),若CH4与N2在不同投料比$\frac{n(C{H}_{4})}{n({N}_{2})}$时CH4的平衡转化率如图所示,下列说法正确的是( )| A. | n(CH4)/n(N2)越大,CH4的转化率越高 | |
| B. | a点对应的平衡常数比c点的大 | |
| C. | b点对应的NH3的体积分数为26% | |
| D. | 不改变投料比,增加n(N2)时,NH3体积分数增大 |
查看答案和解析>>
科目: 来源: 题型:选择题
| X | Y | |
| Z | W |
| A. | 最高正化合价:Z>X=W>Y | |
| B. | 原子半径:Y>X>W>Z | |
| C. | 最高价氧化物对应水化物的酸性:Z<X<W<Y | |
| D. | 最高价含氧酸的钠盐溶液能与SO2反应的:X、Y、Z、W |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com