
科目: 来源: 题型:解答题

 ;D→E的反应类型取代反应.
;D→E的反应类型取代反应. .
. .
. )的合成路线流程图(无机试剂任选).合成路线流程图示例如下:CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH$→_{浓硫酸,△}^{CH_{3}COOH}$CH3COOCH2CH3.
)的合成路线流程图(无机试剂任选).合成路线流程图示例如下:CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH$→_{浓硫酸,△}^{CH_{3}COOH}$CH3COOCH2CH3.查看答案和解析>>
科目: 来源: 题型:解答题
 很多金属、非金属及其化合物在科学研究和工业生产中都有重要用途.回答下列有关问题:
很多金属、非金属及其化合物在科学研究和工业生产中都有重要用途.回答下列有关问题:查看答案和解析>>
科目: 来源: 题型:选择题

| A. | 甲是亚硫酸氢钠粉末投入稀硝酸溶液中的有关图象 | |
| B. | 乙是等pH的MCl2和NCl2溶液稀释时pH变化图象,由此可推测M的金属性较强 | |
| C. | 由丙可知,双氧水在有催化剂存在时的热化学方程式为2H2O2(l)═2H2O(l)+O2(g)△H=-2(Ea2′-Ea2) kJ•mol-1 | |
| D. | 丁是向硝酸银溶液中滴加氨水时,沉淀质量与氨的物质的量的关系图象 |
查看答案和解析>>
科目: 来源: 题型:解答题
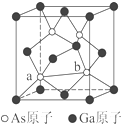 元素周期表第ⅤA族元素包括氮、磷、砷(As)、锑(Sb)等.这些元素无论在研制新型材料,还是在制作传统化肥、农药等方面都发挥了重要的作用.
元素周期表第ⅤA族元素包括氮、磷、砷(As)、锑(Sb)等.这些元素无论在研制新型材料,还是在制作传统化肥、农药等方面都发挥了重要的作用.查看答案和解析>>
科目: 来源: 题型:解答题

| 氟 | 氯 | 溴 | 碘 | |
| 第一电离能(kJ/mol) | 1681 | 1251 | 1140 | 1008 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 该溶液中K+、Mg2+、H+、NO3-不能大量共存 | |
| B. | 溶液中的NH4+与Fe3+均发生水解反应,且相互促进 | |
| C. | 加入金属铜与Fe3+反应的离子方程式为:2Fe3++3Cu=2Fe+3Cu2+ | |
| D. | 向其中滴入Ba(OH)2溶液恰好使SO42-完全沉淀:NH4++Fe3++2SO42-+2Ba2++4OH-=2BaSO4↓+NH3•H2O+Fe(OH)3↓ |
查看答案和解析>>
科目: 来源: 题型:解答题
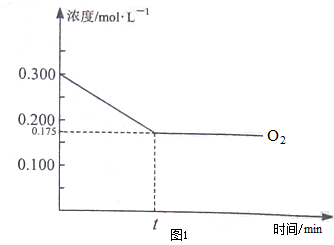

查看答案和解析>>
科目: 来源: 题型:解答题
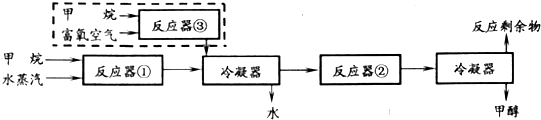
查看答案和解析>>
科目: 来源: 题型:解答题
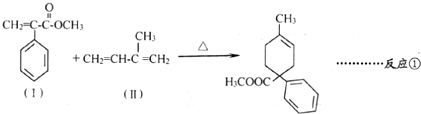
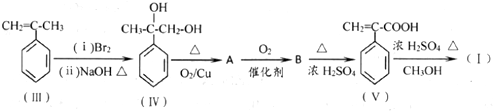
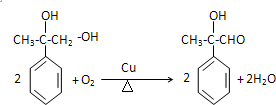 .
. 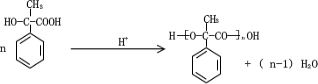 .
.  .
. 和其他无机物叫合成
和其他无机物叫合成 ,最合理的方案
,最合理的方案 $→_{催化剂}^{H_{2}}$
$→_{催化剂}^{H_{2}}$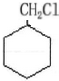 $→_{△}^{NaOH、醇}$
$→_{△}^{NaOH、醇}$ $\stackrel{Cl_{2}}{→}$
$\stackrel{Cl_{2}}{→}$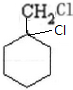
 .
. 查看答案和解析>>
科目: 来源:2017届湖南省长沙市高三上学期第三次月考模拟化学试卷 题型:推断题
(1)某透明溶液仅含Na+、Fe2+、Ba2+、Al3+、NO3-、Cl-、SO42-中的4种离子,所含离子均为1mol.若向该溶液中加入过量的稀硫酸,有气泡产生,且溶液中阴离子种类不变(不考虑水的电离和离子的水解).回答下列问题:
①溶液中存在的离子是;
②写出溶液中加入过量的稀硫酸反应的离子方程式.
(2)CNO-在酸性条件下继续与NaClO反应生成N2、CO2、Cl2等,写出CNO-在酸性条件下被NaClO氧化的离子方程式:________。
(3)酸性KMnO4、H2O2、NaClO在生产、生活、卫生医疗中常用作消毒剂,其中H2O2还可用于漂白,是化学实验室里必备的重要氧化试剂。高锰酸钾造成的污渍可用还原性的草酸(H2C2O4)去除,Fe(NO3)3也是重要氧化试剂,下面是对这三种氧化剂性质的探究。
①向浸泡铜片的稀盐酸中加入H2O2后,铜片溶解,反应的化学方程式________________。
②取300mL0.2mol/L的KI溶液与一定量的酸性KMnO4溶液恰好反应,生成等物质的量的I2和KIO3,则消耗KMnO4的物质的量的是________mol。
③在Fe(NO3)3溶液中加入Na2SO3溶液,溶液先由棕黄色变为浅绿色,过一会又变为棕黄色。写出溶液先变为浅绿色的离子方程式_________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com