
科目: 来源: 题型:多选题
| A. | H2O2+SO2→H2SO4 | |
| B. | 3H2O2+2NaCrO2+2NaOH→2Na2CrO4+4H2O | |
| C. | 2H2O2→2H2O+O2↑ | |
| D. | H2O2+2FeCl3→2FeCl2+2HCl+O2↑ |
查看答案和解析>>
科目: 来源: 题型:选择题
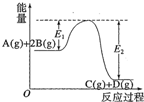
| A. | Q=E2 | |
| B. | 在反应体系中加入催化剂,反应速率增大,E1减小,E2不变 | |
| C. | Q>0,仅升高温度,当反应再次达到平衡时,A的平衡浓度增大 | |
| D. | 1molA(g)和2molB(g)充分反应后放热QkJ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 豆科作物的根瘤菌对空气中氮的固定 | |
| B. | 将NO2气体冷却后颜色会变浅 | |
| C. | 通过煤的液化来提取苯、二甲苯等化工原料 | |
| D. | 工业制液态氧 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 元素原子的最外层电子数等于元素的最高化合价 | |
| B. | 多电子原子中,在离原子核较近的区域内运动的电子能量较高 | |
| C. | P、S、Cl非金属性和最高价氧化物对应的水化物的酸性均依次增强 | |
| D. | 元素周期表中位于金属和非金属分界线附近的元素属于过渡元素 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. |  三甲苯 三甲苯 | B. | CH3CH(C2H5)CH2CH2CH3 2-乙基戊烷 | ||
| C. | CH3CH(NH2)CH2COOH α-氨基丁酸 | D. | 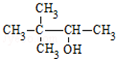 3,3-二甲基-2-丁醇 3,3-二甲基-2-丁醇 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 乙醇汽油比普通汽油保质期长 | |
| B. | 使用乙醇汽油可减少大气雾霾 | |
| C. | 区别两者可用测沸点的方法,普通汽油沸点高 | |
| D. | 区别两者可加入水中,只有普通汽油能分层 |
查看答案和解析>>
科目: 来源: 题型:解答题
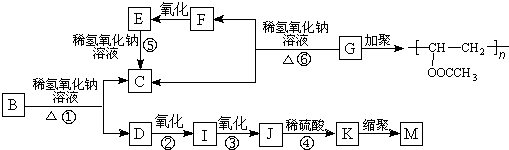
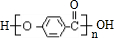 .
. +3NaOH
+3NaOH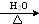 CH3COONa+
CH3COONa+ +NaBr+H2O.
+NaBr+H2O.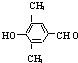 、
、 .
.查看答案和解析>>
科目: 来源: 题型:解答题
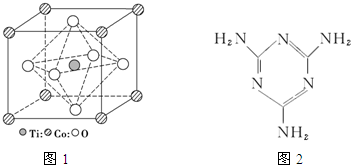 MnO2是碱锰电池材料中最普通的正极材料之一,在活性材料MnO2中加入CoTiO3纳米粉体,可以提高其利用率,优化碱锰电池的性能.
MnO2是碱锰电池材料中最普通的正极材料之一,在活性材料MnO2中加入CoTiO3纳米粉体,可以提高其利用率,优化碱锰电池的性能.查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com