
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 制备硫酸亚铁晶体时,最后在蒸发皿中蒸发浓缩溶液时,只需小火加热至溶液被全部蒸干 | |
| B. | 向1 mL浓度均为0.05 mol•L-1的NaCl、NaI混合溶液中滴加2滴0.01 mol•L-1的AgNO3溶液,振荡,沉淀呈黄色.结论:Ksp(AgCl)<Ksp(AgI) | |
| C. | 0.1mol•L-1的NaOH溶液分别中和pH、体积均相等的醋酸和盐酸,所消耗NaOH溶液的体积:前者小于后者 | |
| D. | 水的电离过程是吸热过程,升高温度,水的离子积增大、pH减小 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 6种 | B. | 7种 | C. | 8种 | D. | 9种 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 电解精炼铜时,若阳极质量减少6.4 g,则电路中转移电子数为0.2NA | |
| B. | 向NH4Al(SO4)2稀溶液中逐滴加入过量Ba(OH)2溶液,离子方程式为:NH4++Al3++2SO42-+2Ba2++5OH-=2BaSO4↓+AlO2-+2H2O+NH3•H2O | |
| C. | 常温下,由水电离出的H+浓度为10-13mol•L-1的溶液中,Fe2+、Cl-、Na+、NO3-可能大量共存 | |
| D. | 葡萄糖(C6H12O6)溶液中:SO42-、MnO4-、K+、H+可以大量共存 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A | B | C | D |
 | 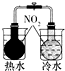 | 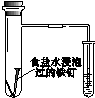 | 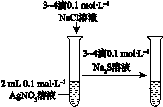 |
| 验证化学能 转化为电能 | 证明温度 对平衡移动的影响 | 验证铁发生析氢腐蚀 | 验证AgCl 溶解度大于Ag2S |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 因为A2-+H2O?HA-+OH-,所以Na2A溶液显碱性 | |
| B. | 0.1 mol/L H2A溶液中氢离子的物质的量浓度为0.11 mol/L | |
| C. | NaHA溶液中各种离子浓度的关系是c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-) | |
| D. | 在NaHA溶液中,HA-电离的趋势大于其水解的趋势 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 加热可增强纯碱溶液去污力:CO32-+2H2O?H2CO3+2OH- | |
| B. | 用铁粉与高温水蒸气反应制取磁性氧化铁3Fe+4H2O$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2 | |
| C. | 用烧碱溶液清洗铝表面的氧化膜:2OH-+Al2O3=2AlO2-+H2O | |
| D. | 用稀硝酸洗涤做过银镜反应的试管:3Ag+4H++NO3-=3Ag++NO↑++2H2O |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 金属腐蚀的本质是金属原子失去电子而被氧化 | |
| B. | 钢铁吸氧腐蚀的正极反应是:O2+4e-+2H2O=4OH- | |
| C. | 氢氧燃料电池中,氢气在负极发生氧化反应 | |
| D. | 将地下钢管与直流电源的正极相连,用来保护钢管 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A | B | C | D | |
| 用 品 |  |  |  |  |
| 主要成分 | CO2 | Fe2O3 | NaHCO3 | CH3COOH |
| 用途 | 做制冷剂 | 做红色涂料 | 除油污 | 做调味剂 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:解答题
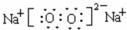 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com