
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:选择题
| A. |  向Ba(OH)2溶液中加稀H2SO4 | B. | 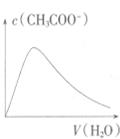 向冰醋酸中加蒸馏水 | ||
| C. |  向稀NaOH溶液中加稀盐酸 | D. | 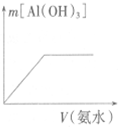 向AlCl3溶液中加氨水 |
查看答案和解析>>
科目: 来源: 题型:选择题
| 实验 | 现象 | 离子方程式 | |
| A |  | 在空气中放置一段时间后,溶液呈蓝色 | 4H++4I-+O2=2I2+2H2O |
| B | 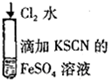 | 溶液由浅绿色变为红色 | 2Fe2++Cl2=2Fe3++2Cl- Fe3++3SCN-=Fe(SCN)3 |
| C |  | 溶液由黄绿色变为无色 | Cl2+2OH-=Cl-+ClO-+H2O |
| D |  | 有白色沉淀生成,溶液由红色变为无色 | Ba2++OH-+H++SO42-=BaSO4+H2O |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:选择题
 某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份,向其中一份中逐渐加入铜粉,最多能溶解19.2g(已知硝酸只能被还原为NO气体).向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示.下列分析或结果错误的是( )
某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份,向其中一份中逐渐加入铜粉,最多能溶解19.2g(已知硝酸只能被还原为NO气体).向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示.下列分析或结果错误的是( )| A. | 原混合液中NO3-的物质的量为0.4 mol | |
| B. | OA段产生是NO,AB段反应为2Fe3++Fe=3Fe2+,BC段产生氢气 | |
| C. | 溶液中最终溶质为FeSO4 | |
| D. | c(H2SO4)为5 mol•L-1 |
查看答案和解析>>
科目: 来源: 题型:解答题
 ) 发生酯化反应的产物.
) 发生酯化反应的产物. 、
、 、
、 任意一种.
任意一种. ,R-ONa$→_{△}^{Cl-R′}$R-O-R′(R-、R′-表烃基)
,R-ONa$→_{△}^{Cl-R′}$R-O-R′(R-、R′-表烃基)
 .
.查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
 研究和深度开发CO、CO2的应用对构建生态文明社会具有重要的意义.
研究和深度开发CO、CO2的应用对构建生态文明社会具有重要的意义.查看答案和解析>>
科目: 来源: 题型:选择题
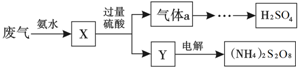
| A. | X可能含有2种盐 | |
| B. | 气体a通入双氧水,可实现“绿色”转化 | |
| C. | Y主要含有(NH4) 2SO4,回收利用作化肥 | |
| D. | (NH4) 2S2O8中S的化合价为+7 |
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | n(NO2-)+n(OH-)-n(H+)=0.1 mol | |
| B. | 若加入少量CH3COONa固体,溶液的碱性会减弱 | |
| C. | 若再通入0.01 mol HCl气体,溶液pH大于2(忽略溶液体积的变化) | |
| D. | 此时溶液的pH大于0.1 mol•L-1的CH3COONa溶液 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 三者的氧化物均为酸性氧化物 | |
| B. | 三者的单质均存在同素异形现象 | |
| C. | CO2、SiO2、SO3都能与H2O反应,其反应类型相同 | |
| D. | 25℃时,物质的量浓度相同的三溶液的pH:Na2SiO3<Na2SO3<Na2CO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com