
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
| 元素 | 相关信息 |
| A | 原子半径是周期表所有元素中最小的 |
| B | 单质常温下为双原子分子,其氢化物水溶液使酚酞变红 |
| C | 基态原子核外S能级上有电子,且p能级上只有一个轨道排满 |
| D | 同周期中电负性最小 |
| E | E的族序数与周期数之差为4 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 除短周期外,其他周期均有18种元素 | |
| B. | 副族元素中没有非金属元素 | |
| C. | 周期表中的第三列是ⅢA | |
| D. | 在过渡元素区能找到大量单质半导体材料 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题

 .
. (任写一种).
(任写一种). 为原料制备
为原料制备 的合成路线流程图(无机试剂任用).合成路线流程图示例如下:
的合成路线流程图(无机试剂任用).合成路线流程图示例如下:
查看答案和解析>>
科目: 来源: 题型:解答题


 (R、R′表示烃基或氢)
(R、R′表示烃基或氢) ,E的结构简式是CH3CHO.
,E的结构简式是CH3CHO.
 .
.查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
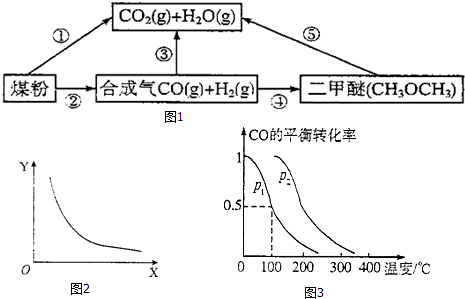
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com