
科目: 来源: 题型:选择题
| 选项 | 操作 | 现象 | 结论 |
| A | ①将湿润的红色石蕊试纸靠近试管口 | 试纸不变色 | NH4Cl受热不分解 |
| B | ②中振荡后静置 | 下层液体颜色变浅 | NaOH溶液可除去溶在溴苯中的Br2 |
| C | ③加热 | 洗气瓶中溶液褪色 | 生成了乙烯 |
| D | ④通电 | A极上有红色固体析出 | 不能说明锌的金属性比铜强 |
| A. |  | B. | 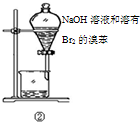 | C. | 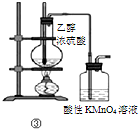 | D. |  |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ①②⑤ | B. | ②④⑥ | C. | ②④ | D. | ③⑤⑥ |
查看答案和解析>>
科目: 来源: 题型:解答题
| 物质 | SiHCl3 | SiCl4 | AsCl3 |
| 沸点/℃ | 32.0 | 57.5 | 131.6 |
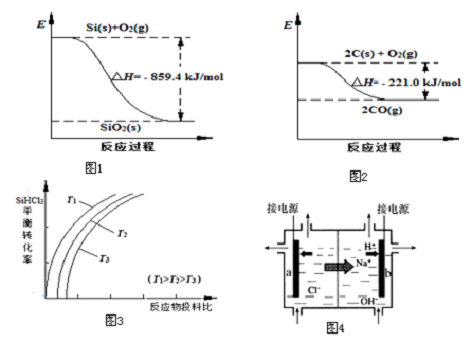
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 3.0 L 0.1 mol•L-1 NaOH溶液中缓慢通入CO2至溶液增重8.8 g时,溶液中:c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+) | |
| B. | 常温下,将CH3COONa溶液和稀盐酸混合至溶液pH=7: c(Na+)>c(CH3COO-)>c(Cl-)=c(CH3COOH)>c(H+)=c(OH-) | |
| C. | 常温下,pH=3的醋酸溶液和pH=13的氢氧化钠溶液等体积混合后(不考虑混合后溶液体积的变化),恰好完全反应,则原醋酸溶液醋酸的电离度为1% | |
| D. | 物质的量浓度之比为1:2的NaClO、NaHCO3混合溶液中:c(HClO)+c(ClO-)=2c(HCO3-)+2c(H2CO3)+2c(CO32-) |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:填空题
| A、NaOH | B、Na2SO4 | C、NH4Cl | |
| c(H+) | 减小 | ① | 增 大 |
| c(OH-) | ② | 不 变 | ③ |
| c(H+)与c(OH-)的大小比较 | ④ | = | > |
| 溶液的酸碱性 | 碱 性 | ⑤ | 酸 性 |
查看答案和解析>>
科目: 来源: 题型:解答题
 化学中的某些元素与生命活动密不可分.请回答下列问题:
化学中的某些元素与生命活动密不可分.请回答下列问题:查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
| 装置 | 现象 | 结论及解释 |
 | ①A试管中黑色沉淀逐渐溶解 ②A试管上方出现红棕色气体 ③B试管中出现白色沉淀 | a.现象②说明褐色沉淀具有 还原性. b.试管B中产生白色沉淀的总反应的离子方程式为 NO2+SO2+Ba2++H2O=BaSO4↓+NO+2H+ |
查看答案和解析>>
科目: 来源: 题型:选择题
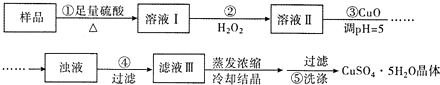
| A. | 步骤②发生的主要反应为:2Fe2++H2O2+2H+=2Fe3++2H2O | |
| B. | 步骤②可用氯水、硝酸等强氧化剂代替H2O2 | |
| C. | 步骤③用 CuCO3代替CuO也可调节溶液的pH | |
| D. | 步骤⑤的操作为:向漏斗中加人少量冷的蒸馏水至浸没晶体,待水自然流下,重复操作 2~3次 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com