
科目: 来源: 题型:选择题
| 选项 | 实验操作或事实 | 实验目的或结论 |
| A | 淡黄色试液$\stackrel{NaOH溶液}{→}$红褐色沉淀 | 说明原溶液中一定含有FeCl3 |
| B | 白色Mg(OH)2 $\stackrel{CuSO_{4}溶液}{→}$蓝色Cu(OH)2 | Mg(OH)2的溶度积大于Cu(OH)2 |
| C | 新收集的酸雨$\stackrel{Ba(NO_{3})_{2}溶液}{→}$白色沉淀 | 酸雨中一定含有SO42- |
| D | H3PO3+2HaOH(足量)═Na2HPO2+2H2O | H3PO3属于三元酸 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:解答题
 铜、锰及其合金是人类常用的金属材料.
铜、锰及其合金是人类常用的金属材料.查看答案和解析>>
科目: 来源: 题型:解答题
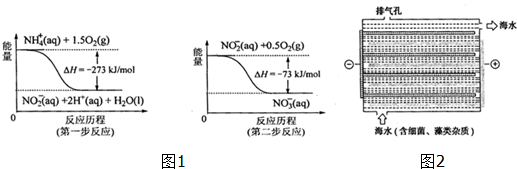
| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度(mol/L) | 3×10-6 | 7×10-6 | 2×10-5 | 3×10-5 | 5×10-5 | 2×10-5 |
查看答案和解析>>
科目: 来源: 题型:选择题
| 弱酸的化学式 | CH3COOH | HCN | H2S |
| 电离常数(25℃) | 1.8×10-5 | 4.9×10-10 | K1=1.3×10-7 K2=7.1×10-15 |
| A. | 等物质的量浓度的各溶液pH关系为:pH(CH3COONa)>pH(Na2S)>pH(NaCN) | |
| B. | a mol•L-1HCN溶液与b mol•L-1NaOH溶液等体积混合,所得溶液中c(Na+)>c(CN-),则a一定小于或等于b | |
| C. | HCN与Na2S溶液一定不能发生反应 | |
| D. | NaHS和Na2S的混合溶液中,一定存在c(Na+)+c(H+)=c(OH-)+c(HS-)+2c(S2-) |
查看答案和解析>>
科目: 来源: 题型:选择题
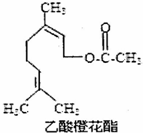
| A. | 该有机物分子式为C12H20O2 | |
| B. | 能发生加成反应和取代反应 | |
| C. | 不能使酸性KMnO4溶液褪色 | |
| D. | 1mol该有机物最多能与2mol NaOH反应 |
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | Y2-的还原性大于Z? | B. | 单质的还原性Z>Y | ||
| C. | b一定小于c | D. | X、Y可处于同周期或X在Y的下周期 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 5.6g金属铁于足量的盐酸反应,转移电子数为0.2NA | |
| B. | 标准状况下,以任意比混合的H2、CO2的混合气体22.4L,所含分子数为NA | |
| C. | 含NA个Na+的Na2O2溶于1L水中,溶质的物质的量浓度为1mol•L-1 | |
| D. | 20g重水(D2O)所含的电子数为10NA |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Al2(SO4)3可除去酸性废水中的悬浮颗粒 | |
| B. | 医药中常用酒精来消毒,是因为酒精能够使细菌蛋白发生变性 | |
| C. | 煤通过气化、液化和干馏等可获得清洁能源和重要的化工原料 | |
| D. | 高锰酸钾溶液和双氧水进行环境消毒时原理相同 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | B的单质不存在同素异形体 | |
| B. | 单质D着火时,可用二氧化碳灭火器灭火 | |
| C. | 化合物A2B2与C2B2均只有氧化性 | |
| D. | A、B、C组成的化合物,25℃时若溶液浓度为0.1mol/L,则由水电离出的OH-为10-13mol/L |
查看答案和解析>>
科目: 来源: 题型:选择题
 利用图所示装置进行以下实验,能得到相应实验结论的是( )
利用图所示装置进行以下实验,能得到相应实验结论的是( )| 选项 | ① | ② | ③ | 实验结论 |
| A | 稀硫酸 | 石灰石 | 澄清石灰水 | 制二氧化碳并吸收尾气 |
| B | 浓硫酸 | 蔗糖 | 溴水 | 浓硫酸具有脱水性、氧化性 |
| C | 稀盐酸 | Na2SO3 | H2S溶液 | SO2具有还原性 |
| D | 浓硝酸 | Na2CO3 | Na2SiO3溶液 | 酸性:硝酸>碳酸>硅酸 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com