
科目: 来源: 题型:选择题
| A. | ①④⑧ | B. | ⑤⑧ | C. | ②⑤⑥⑦ | D. | ③ |
查看答案和解析>>
科目: 来源: 题型:解答题
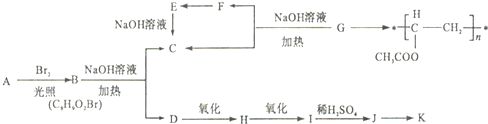
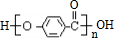
 .
. .
.查看答案和解析>>
科目: 来源: 题型:选择题
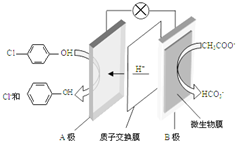 现在污水治理越来越引起人们重视,可以通过膜电池除去废水中的乙酸钠和对氯苯酚(
现在污水治理越来越引起人们重视,可以通过膜电池除去废水中的乙酸钠和对氯苯酚(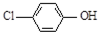 ),其原理如图所示,下列说法正确的是( )
),其原理如图所示,下列说法正确的是( )| A. | 当外电路中有0.2mole-转移时,通过质子交换膜的H+的个数为0.2NA | |
| B. | A极的电极反应式为 +e-═Cl-+ +e-═Cl-+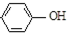 | |
| C. | 电流方向从B极沿导线经小灯泡流向A极 | |
| D. | B为电池的正极,发生还原反应 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 含有AgCl和AgI固体的悬浊液:c(Ag+)>c(C1-)=c(I-) | |
| B. | pH=1的NaHSO4溶液:c(H+)═c(SO42-)+c(OH-) | |
| C. | 常温下,0.1mol•L-1的①NH4Cl ②CH3COONH4 ③NH4HSO4溶液中:c(NH4+)大小顺序:①>②>③ | |
| D. | 物质的量浓度之比为1:2的NaClO、NaHCO3混合溶液中:c(HClO)+c(ClO-)═2c(HCO${\;}_{3}^{-}$)+2c(H2CO3)+2c(CO${\;}_{3}^{2-}$) |
查看答案和解析>>
科目: 来源: 题型:选择题
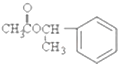
| A. | 该栀子酯的分子式C10H11O2 | |
| B. | 1mol栀子酯水解需要消耗2mol NaOH | |
| C. | 栀子酯可以发生加成、取代和消去反应 | |
| D. | 栀子酯的一氯代物有六种 |
查看答案和解析>>
科目: 来源: 题型:解答题
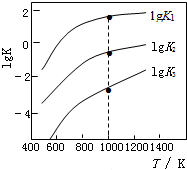 (1)一定条件下,向一带活塞的密闭容器中充入2mol SO2和1mol O2发生反应:2SO2(g)+O2(g)═2SO3(g),下列说法中,正确的是C.
(1)一定条件下,向一带活塞的密闭容器中充入2mol SO2和1mol O2发生反应:2SO2(g)+O2(g)═2SO3(g),下列说法中,正确的是C.| 相关反应 | 反应热 | 平衡常数K |
| FeS2(s)+H2(g)?FeS(s)+H2S(g) | △H1 | K1 |
| $\frac{1}{2}$FeS2(s)+H2(g)?$\frac{1}{2}$Fe(s)+H2S(g) | △H2 | K2 |
| FeS(s)+H2(g)?Fe(s)+H2S(g) | △H3 | K3 |
查看答案和解析>>
科目: 来源: 题型:选择题
 室温下,0.2mol/L的一元碱BOH与等浓度的盐酸等体积混合后,所得溶液中部分微粒的组分及浓度如图所示,下列对混合溶液的分析正确的是( )
室温下,0.2mol/L的一元碱BOH与等浓度的盐酸等体积混合后,所得溶液中部分微粒的组分及浓度如图所示,下列对混合溶液的分析正确的是( )| A. | 溶液显中性 | B. | 升温,c(X)增大,c(Y)减小 | ||
| C. | c(B+)+c(Y)=c(Cl-) | D. | 稀释溶液,c(X)增大,c(Z)增大 |
查看答案和解析>>
科目: 来源: 题型:多选题
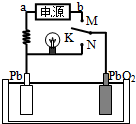 如图是铅蓄电池充、放电时的工作示意图,电解质是H2SO4溶液.已知放电时电池反应为:Pb+PbO2+4H++2SO42-═2PbSO4+2H2O.下列有关说法正确的是( )
如图是铅蓄电池充、放电时的工作示意图,电解质是H2SO4溶液.已知放电时电池反应为:Pb+PbO2+4H++2SO42-═2PbSO4+2H2O.下列有关说法正确的是( )| A. | K与N相接时,能量由化学能转化为电能 | |
| B. | K与N相接时,H+向负极区迁移 | |
| C. | K与M连接时,所用电源的a极为负极 | |
| D. | K与M相接时,阳极附近的pH逐渐增大 |
查看答案和解析>>
科目: 来源: 题型:解答题
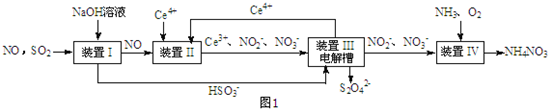
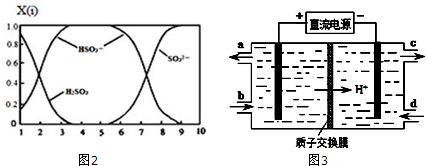
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 室温下,0.001 mol•L-1的醋酸中由水电离的c(H+)=10-11mol•L-1 | |
| B. | Na2CO3溶液中存在c(Na+)+c(H+)═c(OH-)+a c(X)+b c(Y),若X为HCO3-,则b=2 | |
| C. | 某温度下,浓度均为0.01mol•L-1的盐酸和氢氧化钠溶液的pH分别为2和12 | |
| D. | 向0.1mol•L-1氯化铵溶液滴加几滴浓盐酸,c(NH4+)减小,PH增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com