
科目: 来源: 题型:解答题
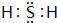 .
.查看答案和解析>>
科目: 来源: 题型:解答题
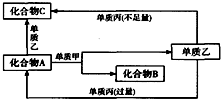 A、B、C都是由两种元素组成的无机物,它们和单质甲、乙、丙在如图所示的转化关系(转化过程都不需要使用催化剂).
A、B、C都是由两种元素组成的无机物,它们和单质甲、乙、丙在如图所示的转化关系(转化过程都不需要使用催化剂).查看答案和解析>>
科目: 来源: 题型:解答题

| 操作 | 现象 | 结论 |
| 假设三正确 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 浓硝酸和乙胺反应属于加成反应 | |
| B. | 室溫离子可以使熔盐燃料电池在常溫下工作 | |
| C. | CH3CH2NO3中,只有σ键没有π键 | |
| D. | 融化CH3CH2•NO3晶体需要破坏分子间作用力 |
查看答案和解析>>
科目: 来源: 题型:选择题
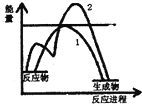 对于CH3COOH+CH3CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O反应有关叙述正确的是( )
对于CH3COOH+CH3CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O反应有关叙述正确的是( )| A. | 浓硫酸在该反应中起着降低反应活化能和提高原料转化率作用 | |
| B. | 该反应属于消去反应 | |
| C. | 如图表示放热反应的图象.曲线1表示未加催化剂, 则曲线2表示加了催化剂 | |
| D. | 该反应为放热反应,故升髙温度正反应速度减小,逆反应速度加快 |
查看答案和解析>>
科目: 来源: 题型:选择题
 利用如图装置可以制取某些气体,所用药品合理且收集气体方法正确的是( )
利用如图装置可以制取某些气体,所用药品合理且收集气体方法正确的是( )| 制取气体 | 实验药品 | 收集气体方法 | |
| A | 二氧化碳 | 碳酸钙、稀硫酸 | 排饱和碳酸氢钠溶液 |
| B | 氧气 | 双氧水、二氧化锰 | 排水法 |
| C | 氨气 | 氧氡化钠溶液、浓氨水 | 向下排空气法 |
| D | 乙烯 | 氯乙烷,氢氧化钠、乙醇 | 排水法 |
| A. | A、 | B. | B、 | C. | C、 | D. | D、 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 该溶液中,K+、Mg2+、NH3•H2O、Cl-可以大量共存 | |
| B. | 与足量Ba(OH)2溶液反应的离子方裎式:Fe2++SO42-+Ba2++2OH-=Fe(OH)2↓+BaSO4↓ | |
| C. | (NH4)2Fe(SO4)2溶液久置空气中变质的离子方程式:12Fe2++3O2+6H2O=4Fe(OH)3↓+8Fe3+ | |
| D. | 向该溶液中滴加适量的酸性KMnO4溶液使其恰好反应溶液褪为无色 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | H2O为直线型分子 | |
| B. | 反应中每生成1molS转移了2mol电子 | |
| C. | NaHS中含离子键和非极性键 | |
| D. | 琉单质(S8)为原子晶体 |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:填空题
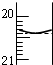 氧化还原滴定同中和滴定类似(用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之).现有0.001000mol/L酸性KMnO4溶液和10.00mL未知浓度的无色NaHSO3溶液,反应的离子方程式是:
氧化还原滴定同中和滴定类似(用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之).现有0.001000mol/L酸性KMnO4溶液和10.00mL未知浓度的无色NaHSO3溶液,反应的离子方程式是:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com