
科目: 来源: 题型:解答题
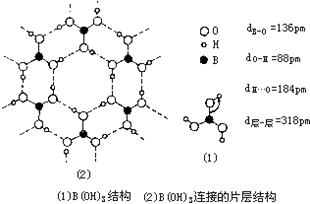 硼及其化合物在现代工业、生活和国防中有重要应用价值.
硼及其化合物在现代工业、生活和国防中有重要应用价值.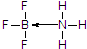 .
.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | X只有1种结构 | |
| B. | 雌性信息素可能是烯烃,会使溴水褪色 | |
| C. | 电解的阳极反应式为:C21H41COOH+X+2H2O-2e-→C23H46+2CO32-+6H+ | |
| D. | 阴极的还原产物为H2 |
查看答案和解析>>
科目: 来源: 题型:解答题
| 实验操作步骤 | 预期现象与结论 |
| 步骤1:用药匙取少许样品于试管中,用滴管滴加适量的3mol•L-1H2SO4溶液,加热,充分反应后得到A溶液 | - |
| 步骤2:取2mLA溶液于试管中,用胶头滴管滴加1~2滴20%KSCN溶液,振荡试管 | 若溶液变红色,样品中含+3价的铁元素 |
| 步骤3:另取2mLA溶液于试管中,用胶头滴管滴加1~2滴0.01mol•L-1KMnO4溶液,振荡试管 | 若溶液的紫红色褪去,样品中含+2价的铁元素 |

查看答案和解析>>
科目: 来源: 题型:解答题
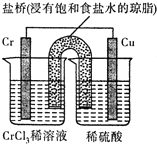 铬(Cr)是周期表中VIB族元素,化合价可以是 0~+6 的整数价态.回答下列问题:
铬(Cr)是周期表中VIB族元素,化合价可以是 0~+6 的整数价态.回答下列问题: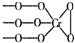 ,则Cr的化合价为+5.
,则Cr的化合价为+5.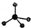 .CrO72-由两个CrO42-四面体组成,这两个CrO42-四面体通过共用一个角顶氧原子彼连,结构为
.CrO72-由两个CrO42-四面体组成,这两个CrO42-四面体通过共用一个角顶氧原子彼连,结构为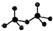 .则由n(n>1)个CrO42-通过角顶氧原子连续的链式结构的化学式为CrnO(3n+1)2-.
.则由n(n>1)个CrO42-通过角顶氧原子连续的链式结构的化学式为CrnO(3n+1)2-.查看答案和解析>>
科目: 来源: 题型:选择题
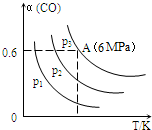
| A. | p1>p2>p3 | |
| B. | 若断裂碳氢键、氢氢键的速率相等,则该反应为平衡状态 | |
| C. | 已知从反应开始到平衡点A需要时间10min.在0~10分钟内的平均速率v(H2)=0.18mol/(L•min) | |
| D. | A点的平衡常数Kp=$\frac{1}{64}$(Kp是用平衡时各组分的分压代替其浓度的平衡常数.组分分压=混合气体总压强X该组分的物质的量分数) |
查看答案和解析>>
科目: 来源: 题型:解答题
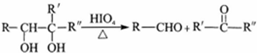
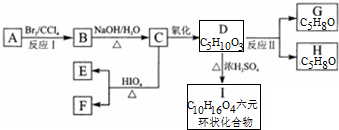
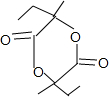 +2H2O.
+2H2O.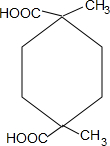 .
.查看答案和解析>>
科目: 来源: 题型:选择题
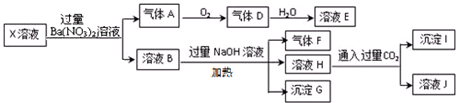
| A. | X中肯定存在Fe2+、A13+、NH4+、C1- | |
| B. | X中不能确定的离子是 K+和C1- | |
| C. | 沉淀G在空气中放置过程中,沉淀颜色会由白色变为灰绿色最后变为红褐色 | |
| D. | 标准状况下将一试管D气体倒扣在水槽中充分吸收(假设所得溶液没有扩散),所得溶液物质的量浓度约为0.036mol/L |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 胶体区别于其它分散系的本质特征是具有丁达尔现象 | |
| B. | 煤的气化、石油分馏、海水制镁、海带提碘等过程中都包含化学变化 | |
| C. | 棉花和木材的主要成分都是纤维素,蚕丝、羊毛和人造丝的主要成分都是蛋白质 | |
| D. | 甲苯能够被酸性高锰酸钾溶液氧化成苯甲酸,而甲烷不反应,说明苯环能够使甲基变活泼 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 在沸腾炉和接触室中,均使用过量的高压空气,以提高硫铁矿的燃烧利用率和二氧化硫的催化氧化转化率 | |
| B. | 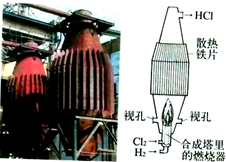 如图是工业制盐酸的设备及其简易图 | |
| C. | 氯碱工业是中国现代化工之母,其主要反应是电解海水,得到烧碱和氯气,因此称为氯碱工业 | |
| D. | 合成氨工业是工业制硝酸和工业制纯碱的前提和保证,前者可为后两者共提供了不止一种原料 |
查看答案和解析>>
科目: 来源: 题型:解答题
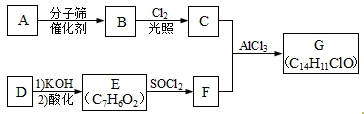
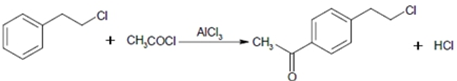
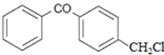 .
.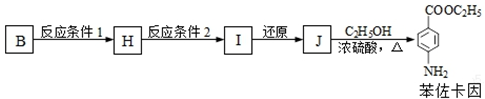
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com