
科目: 来源: 题型:解答题
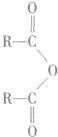 $\stackrel{H_{2}O}{→}$2RCOOH
$\stackrel{H_{2}O}{→}$2RCOOH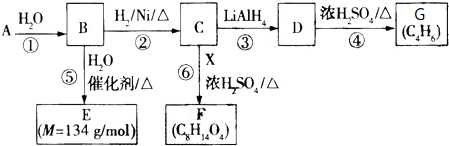
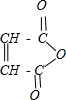 .⑤的反应类型是加成反应.G与Br2的CCl4溶液反应,所有可能的产物共有3种.
.⑤的反应类型是加成反应.G与Br2的CCl4溶液反应,所有可能的产物共有3种. .
. .
.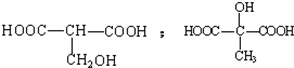 .
.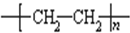

 .
.查看答案和解析>>
科目: 来源: 题型:解答题
 .
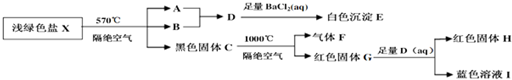
.
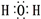 .
.查看答案和解析>>
科目: 来源: 题型:解答题
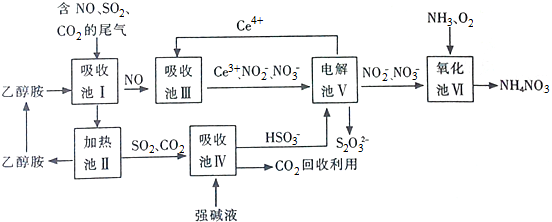
查看答案和解析>>
科目: 来源: 题型:解答题
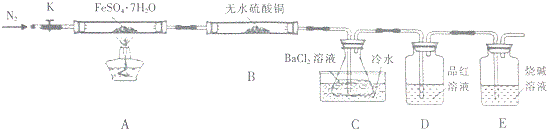
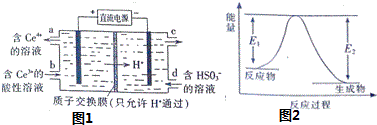
查看答案和解析>>
科目: 来源: 题型:解答题
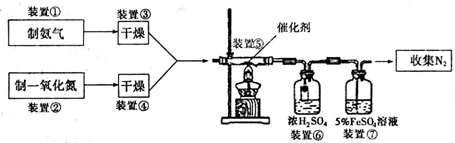

查看答案和解析>>
科目: 来源: 题型:解答题
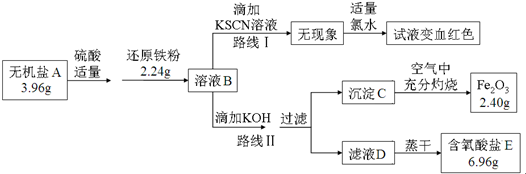
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 用CoCl2溶液浸泡过的棉花制成简易湿度计,悬挂在家中,以粗略估计空气的湿度 | |
| B. | 在1mL0.5mol/L的AlCl3溶液中加入2mL饱和的NaF溶液,再加入1mL3.mol/L的氨水,整个过程都无明显现象 | |
| C. | 向1mL1%的NaOH溶液中加入2ml2%的CuSO4溶液,振荡后再加入0.5mL有机物X,溶液呈现绛蓝色,则X是甘油 | |
| D. | 用标准NaOH溶液滴定待测食醋溶液时,锥形瓶水洗后未用待测液润洗,碱式滴定管尖嘴部分有气泡,滴定后气泡消失,则测定结果偏高 |
查看答案和解析>>
科目: 来源: 题型:解答题
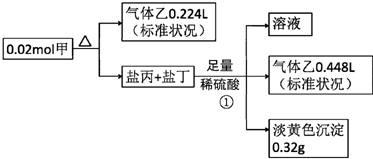
 ,甲的化学式Na2S2O4
,甲的化学式Na2S2O4查看答案和解析>>
科目: 来源: 题型:解答题
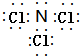 ;A在一定条件下能与水反应,可用于饮用水的消毒,试写出此反应的化学反应方程式NCl3+3H2O=NH3+3HClO.
;A在一定条件下能与水反应,可用于饮用水的消毒,试写出此反应的化学反应方程式NCl3+3H2O=NH3+3HClO.查看答案和解析>>
科目: 来源: 题型:解答题
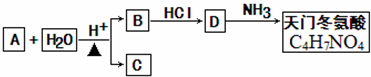
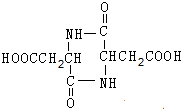 +2H2O.
+2H2O.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com