
科目: 来源: 题型:选择题
| A. | Na2CO3 是碱 | B. | Na2C03 是盐 | C. | Na2C03是钠盐 | D. | Na2CO3是碳酸盐 |
查看答案和解析>>
科目: 来源: 题型:解答题
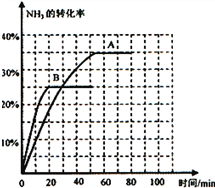 氨气是一种重要的化工产品,是生产铵盐、尿素等的原料.现有如下两种合成氨的途径:
氨气是一种重要的化工产品,是生产铵盐、尿素等的原料.现有如下两种合成氨的途径:| 时间/min | 0 | 30 | 70 | 80 | 100 |
| n(CO2)/mol | 0.10 | 0.060 | 0.040 | 0.040 | 0.040 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 1.8g重水中含有的电子数为NA | |
| B. | 1L0.1mol/L FeCl3溶液中含有的Cl- 数为0.3NA | |
| C. | 25℃,1L pH=13的Ba(OH)2溶液中含有的oH-数为0.2NA | |
| D. | 标准状况下,2.24L NO和NO2混合气体中含有的氧原子数为0.15NA |
查看答案和解析>>
科目: 来源: 题型:解答题
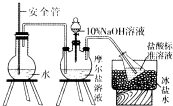 硫酸亚铁铵俗名摩尔盐.化学式为x(NH4)2SO4•yFeSO4•zH2O,可用来净水或治疗缺铁性贫血等.某实验小组利用下面的方法来测定其组成.
硫酸亚铁铵俗名摩尔盐.化学式为x(NH4)2SO4•yFeSO4•zH2O,可用来净水或治疗缺铁性贫血等.某实验小组利用下面的方法来测定其组成.查看答案和解析>>
科目: 来源: 题型:解答题
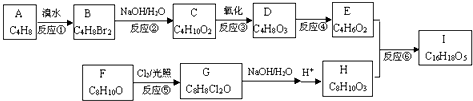
 .
.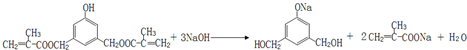 .
.查看答案和解析>>
科目: 来源: 题型:解答题
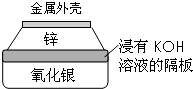 金属作为一种能源受到越来越多的关注.
金属作为一种能源受到越来越多的关注.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 1molCO2通入750mL 2mol/LKOH溶液中:(K+)=2 c(CO32-)+c(HCO3-)+c(H2CO3) | |
| B. | 加入铝粉有气泡产生的溶液中存在离子:Na+、NH4+、Fe2+、NO3- | |
| C. | 等物质的量Na2CO3、Ca(OH)2、HCl物质混合反应的离子方程式:CO32-+Ca2++H++OH-=CaCO3↓+H2O | |
| D. | Ca与O元素形成化合物中只有离子键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com