
科目: 来源: 题型:选择题
| 选项 | 实验目的 | 主要仪器 | 试剂 |
| A | 配制480mL 2mol/L的NaOH溶液 | 胶头滴管、烧杯、玻璃棒、托盘天平、480mL容量瓶 | NaOH固体、蒸馏水 |
| B | 测定中和热 | 烧杯、玻璃棒、纸板、保温塑料、温度计 | 50mL0.5mol/LNaOH溶液与50mL0.5mol/L盐酸 |
| C | 测定生成H2速率 | 分液漏斗、锥形瓶、针筒、铁架台 | Zn粒、稀硫酸 |
| D | 浓硫酸脱水性 | 分液漏斗、试管 | 蔗糖 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 硅石常用作光导纤维、光学仪器的原料 | |
| B. | Al(OH)3可作阻燃剂,因此可以用于灭火 | |
| C. | 酚醛树脂可作木材粘合剂、制作食用器具 | |
| D. | H2O2在过氧化氢酶的催化下,随着温度的升高,分解速率持续加快 |
查看答案和解析>>
科目: 来源: 题型:解答题
| 离子晶体 | NaCl | KCl | CaO |
| 晶格能/kJ•mol-1 | 786 | 715 | 3401 |
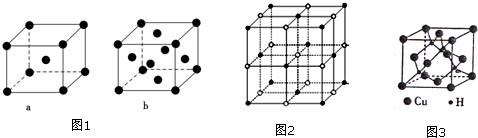
查看答案和解析>>
科目: 来源: 题型:解答题
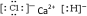 .
.查看答案和解析>>
科目: 来源: 题型:解答题
 是地球上最常见的物质之一,是所有生命体生存的重要资源,约占人体体重的三分之二.
是地球上最常见的物质之一,是所有生命体生存的重要资源,约占人体体重的三分之二. 无色,无气味并且易燃.是常见的一种基础能源.
无色,无气味并且易燃.是常见的一种基础能源.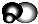 有强氧化性的弱酸,可以用于消毒杀菌.
有强氧化性的弱酸,可以用于消毒杀菌.查看答案和解析>>
科目: 来源: 题型:解答题
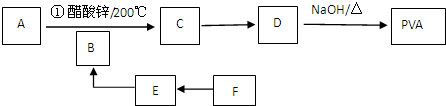
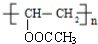 +n NaOH→
+n NaOH→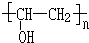 +n CH3COONa.
+n CH3COONa.查看答案和解析>>
科目: 来源: 题型:选择题
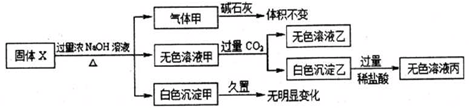
| A. | 气体甲一定是纯净物 | |
| B. | 将过量的无色溶液乙和少量无色溶液丙混合既有无色气体生成,也有白色沉淀生成 | |
| C. | 固体X中一定存在AlCl3、(NH4)2SO4,MgCl2 | |
| D. | 白色沉淀甲可能是混合物 |
查看答案和解析>>
科目: 来源: 题型:选择题
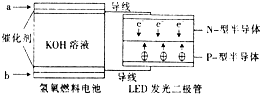 LED系列产品是被看好的一类节能新产品.如图是一种氢氧燃料电池驱动LED 发光的装置.下列有关叙述正确的是( )
LED系列产品是被看好的一类节能新产品.如图是一种氢氧燃料电池驱动LED 发光的装置.下列有关叙述正确的是( )| A. | a处通入氢气,发生还原反应 | |
| B. | b处为电池正极,发生了还原反应 | |
| C. | 该装置中只涉及两种形式的能量转化 | |
| D. | P-型半导体连接的是电池负极 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 某烷烃的名称为2,2,4,4-四甲基-3,3,5-三乙基己烷 | |
| B. | 等质量的甲醛与乳酸[CH3CH(OH)COOH]完全燃烧消耗氧气的量不相等 | |
| C. | 如图是某有机物分子的比例模型,该物质可能是一种氨基酸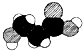 | |
| D. | 化合物 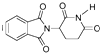 在酸性条件下水解,所得溶液加碱后加热有NH3生成 在酸性条件下水解,所得溶液加碱后加热有NH3生成 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | A、C两种元素可组成化学式为C2A4的化合物 | |
| B. | E氧化物的水化物有两性 | |
| C. | F与D形成的化合物性质很不活泼,不与任何酸反应 | |
| D. | 元素的非金属性由强到弱的顺序是D>C>F>B |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com