
科目: 来源: 题型:选择题
| 选项 | 实验操作 | 实验现象 | 解释或结论 |
| A | 用某无色溶液进行焰色反应 | 焰色呈黄色 | 原溶液一定是钠盐溶液 |
| B | 向NaOH溶液中滴加足量的MgCl2 溶液,然后再滴加足量的CuCl2溶液 | 先产生白色沉淀, 然后沉淀变蓝色 | KSP[Cu(OH)2]>KSP[Mg(OH)2] |
| C | 将水蒸汽通过灼热的铁粉 | 粉末变红 | 铁与水蒸汽在高温下发生 反应 |
| D | 将充满NO2的密闭玻璃球浸泡在热水中 | 红棕色变深 | 反应2NO2(g)═N2O4(g) △H<0 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 用水可以鉴别乙醇、苯、和溴苯 | |
| B. | 甲苯与氯气在光照下可发生取代反应,主要生成2,4-二氯甲苯 | |
| C. | 化学式为C7H16的有机物,分子中含有3个甲基的可能结构有3种 | |
| D. | 乙酸丁酯中含乙酸杂质,可以加入饱和碳酸钠溶液洗涤,然后通过分液来去除杂质 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 烧碱、冰醋酸、四氯化碳均为电解质 | |
| B. | 不同元素的原子构成的分子中只含极性共价键 | |
| C. | IA族与ⅦA族元素间可形成共价化合物或离子化合物 | |
| D. | 2NO(g)+2CO(g)=N2(g)+2CO2(g)在常温下可自发进行,则该反应的△H>0 |
查看答案和解析>>
科目: 来源: 题型:解答题
| 键能 | 半径 | 键的极性 | 沸点 |
| H-Cl>H-I | Cl-<Br- | H-Cl>H-Br | HF>HI |
查看答案和解析>>
科目: 来源: 题型:选择题
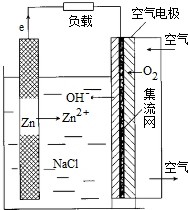
| A. | 放电时,电池正极反应式为:O2+H++4e-=2H2O | |
| B. | 增大空气进气口直径,可增大电池输出能力并延长电池使用寿命 | |
| C. | 放电时,每通入2.24L空气(标准状况),理论上负极需要消耗13gZn | |
| D. | 电池用完后,只需更换封装好的锌粉或电池锌板即可 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 含有CH3COONa的溶液都能增大水的电离程度 | |
| B. | pH=5的HCl与pH=5的NH4Cl等体积混合,溶液pH仍为5 | |
| C. | 将AgI和AgBr的饱和溶液等体积混合,再加入足量浓AgNO3溶液,产生的沉淀主要是AgBr | |
| D. | 20mL0.1mol/LNH3•H2O与10mL0.1mol/LHCl充分反应,所得溶液pH=9中c(NH3•H2O)>c(Cl-)>c(OH-) |
查看答案和解析>>
科目: 来源: 题型:选择题
| A | B | C | D | |
| 装置图 | 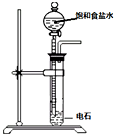 | 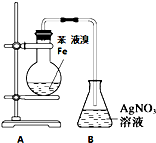 | 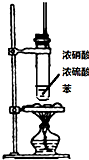 | 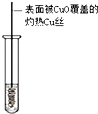 |
| 实验目的 | 乙炔的制备 | AgNO3验证苯与液溴发生取代反应 | 制备硝基苯 | 验证乙醇的还原性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 断开1molH-H键需要的能量小于断开1molCl-Cl键需要的能量 | |
| B. | 反应在光照和加热条件下的△H不同 | |
| C. | 反应①的活化能小于反应②的活化能 | |
| D. | 已知反应②的△H>0,则反应③的△H一定小于0 |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com