
科目: 来源: 题型:选择题
| A. | 氢氧化铝、碳酸钠都是常见的胃酸中和剂 | |
| B. | 红葡萄酒密封储存时间越长质量越好原因之一是生成了有香味的酯 | |
| C. | 碘酒中的碘因有还原性而起到杀菌消毒作用 | |
| D. | 食盐、食醋、味精是常用的食品添加剂,其主要成分均属于钠盐 |
查看答案和解析>>
科目: 来源: 题型:解答题
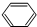 .
. +3H2$\stackrel{催化剂}{→}$
+3H2$\stackrel{催化剂}{→}$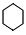
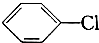 :
: +Cl2$\stackrel{FeCl_{3}}{→}$
+Cl2$\stackrel{FeCl_{3}}{→}$ +HCl.
+HCl.查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 标准状况下,11.2 L SO3所含的氧原子数为1.5NA | |
| B. | 电解精炼铜时,若阳极质量减少6.4 g,则电路中转移电子数为0.2NA | |
| C. | 常温常压下,7.8 gNa2S和Na2O2的混合物中,阴离子所含电子数为1.8 NA | |
| D. | 在含Al3+总数为NA的AlCl3溶液中,Cl-总数为3NA |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 石油裂解、煤的气化、海水制镁都包含化学变化 | |
| B. | 福尔马林用于制备标本是利用了其使蛋白质变性的性质 | |
| C. | 红葡萄酒储藏时间长后变香可能是因为乙醇发生了酯化反应 | |
| D. | 含钙、钡、铁等金属元素的物质有绚丽的颜色,可用于制造焰火 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
 在室温下,向0.02mol/L的Na2CrO4溶液中滴加0.01mol/L的稀硫酸,溶液由黄色转变成橙红色的Na2Cr2O7,溶液中水Kw增大,在此转化过程中,各物质的量浓度变化如图所示.下列说法正确的是( )
在室温下,向0.02mol/L的Na2CrO4溶液中滴加0.01mol/L的稀硫酸,溶液由黄色转变成橙红色的Na2Cr2O7,溶液中水Kw增大,在此转化过程中,各物质的量浓度变化如图所示.下列说法正确的是( )| A. | 向以上反应加入一定量的Na2CO3溶液,对平衡几乎没有影响 | |
| B. | 升高温度,混合溶液的颜色逐渐加深 | |
| C. | 该反应的离子方程式为:2CrO42-+2H+═Cr2O72-+H2O | |
| D. | 该反应的化学平衡常数为5.0x102 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com