
科目: 来源: 题型:多选题
 乙醇分子中不同的化学键如图所示,对乙醇在各种反应中应断裂的键说明不正确的是( )
乙醇分子中不同的化学键如图所示,对乙醇在各种反应中应断裂的键说明不正确的是( )| A. | 与金属钠作用时,键①断 | |
| B. | 浓硫酸共热至170℃时,键②和⑤断裂 | |
| C. | 和乙酸、浓硫酸共热时,键②断裂 | |
| D. | 在银催化下和氧气反应时,键①和④断裂 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 丙酸遇紫色石蕊试剂变红 | B. | 丙酸与乙醇的酯化反应是取代反应 | ||
| C. | 丙酸和乙酸互为同系物 | D. | 丙酸存在多种羧酸类同分异构体 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 118号元素属于第八周期元素 | |
| B. | 118号元素是一种金属元素 | |
| C. | 118号元素的原子核中含有118个质子 | |
| D. | 118号元素原子经化学反应后可转化成其他元素的原子 |
查看答案和解析>>
科目: 来源: 题型:解答题
 H、C、N、F、Al、Ca、Ni、Cu是中学阶段常见的元素,回答下面几个小题
H、C、N、F、Al、Ca、Ni、Cu是中学阶段常见的元素,回答下面几个小题查看答案和解析>>
科目: 来源: 题型:选择题
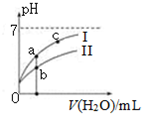 已知:下表为25℃时某些弱酸的电离平衡常数.
已知:下表为25℃时某些弱酸的电离平衡常数.| CH3COOH | HClO | H2CO3 |
| Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.4×10-7Ka2=4.7×10-11 |
| A. | 相同浓度的CH3COONa和NaClO的混合溶液中,各离子浓度的大小关系是:c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+) | |
| B. | 向NaClO溶液中通入少量二氧化碳的离子方程式为:ClO-+CO2+H2O=HClO+CO32- | |
| C. | 图象中a、c两点处的溶液中$\frac{c({R}^{-})}{c(HR)•c(O{H}^{-})}$相等(HR代表CH3COOH或HClO) | |
| D. | 图象中a点酸的总浓度大于b点酸的总浓度 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 草酸可使酸性高锰酸钾溶液褪色,其离子方程式为:2MnO4-+5C2O42-+16H+=2Mn2++10CO2↑+8H2O | |
| B. | 向NH4Al(SO4)2溶液中加入过量的Ba(OH)2稀溶液:NH4++Al3++2SO42-+2Ba2++5OH-=2BaSO4↓+NH3•H2O+AlO2-+2H2O | |
| C. | NaHSO3溶液与FeCl3反应的离子方程式:SO32-+2Fe3++H2O=SO42-+2Fe2++2H+ | |
| D. | NH4HCO3溶液中加入少量NaOH:NH4++OH-═NH3•H2O |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 纯碱、Na2O2、NH4NO3、Ca(OH)2均为离子化合物 | |
| B. | HCl、H2SO4、HNO3均具有氧化性,都是氧化性酸 | |
| C. | 经分析某物质只含有一种元素,则该物质一定是纯净物 | |
| D. | 金属氧化物一定是碱性氧化物 |
查看答案和解析>>
科目: 来源: 题型:解答题

 .
.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 上式中的X为S4O62- | |
| B. | 该反应中的还原剂为Fe2+和S2O32- | |
| C. | 当3 mol Fe2+被氧化时,被Fe2+还原的O2的物质的量为1 mol | |
| D. | 当生成1 mol Fe3O4时,转移电子的物质的量为4 mol |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com