
科目: 来源: 题型:选择题
 用Na2SO3溶液吸收硫酸工业尾气中的二氧化硫,将所得的混合液进行电解循环再生,这种新工艺叫再生循环脱硫法.其中阴、阳离子交换膜组合循环再生机理如图所示,则下列有关说法中不正确的是( )
用Na2SO3溶液吸收硫酸工业尾气中的二氧化硫,将所得的混合液进行电解循环再生,这种新工艺叫再生循环脱硫法.其中阴、阳离子交换膜组合循环再生机理如图所示,则下列有关说法中不正确的是( )| A. | X为直流电源的负极,Y为直流电源的正极 | |
| B. | 阳极区pH增大 | |
| C. | 图中的b>a | |
| D. | 该过程中的产品还有H2SO4 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | CO、NO、NO2都是大气污染气体,在空气中都能稳定存在 | |
| B. | NO可用于某些疾病的治疗 | |
| C. | NO2通入FeSO4溶液中始终无明显现象 | |
| D. | 汽车尾气的主要污染成分包括NO、CO和N2 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
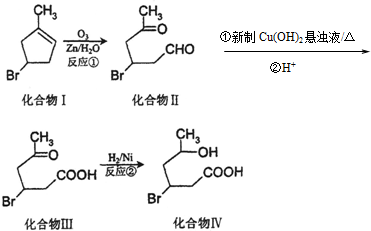
 +2Cu(OH)2$\stackrel{△}{→}$
+2Cu(OH)2$\stackrel{△}{→}$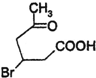 +Cu2O↓+2H2O.
+Cu2O↓+2H2O.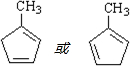 .
. .
.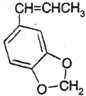 发生类似反应①的反应,得到乙醛和化合物Y,Y的结构简式为
发生类似反应①的反应,得到乙醛和化合物Y,Y的结构简式为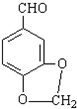 .
.查看答案和解析>>
科目: 来源: 题型:选择题

| A. | 用稀硫酸代替AgNO3溶液,也可形成原电池 | |
| B. | 银片为负极,发生的反应为:Ag++e-=Ag | |
| C. | 进行实验时,琼脂中K+移向Mg(NO3)2溶液 | |
| D. | 取出盐桥,电流表依然有偏转 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | H+ Fe3+ ClO-Cl- | B. | H+ SO32-Fe2+ NO3- | ||
| C. | Ag+ K+ Cl-SO42- | D. | K+ NH4+Cl- CO32- |
查看答案和解析>>
科目: 来源: 题型:解答题
 甲醇是一种重要的化工原料.
甲醇是一种重要的化工原料.| CO2%-CO%-H2% (体积分数) | 0-30-70 | 2-28-70 | 4-26-70 | 8-22-70 | ||||||||
| 反应温度/℃ | 225 | 235 | 250 | 225 | 235 | 250 | 225 | 235 | 250 | 225 | 235 | 250 |
| 生成CH3OH的碳转化率(%) | 4.9 | 8.8 | 11.0 | 36.5 | 50.7 | 68.3 | 19.0 | 33.1 | 56.5 | 17.7 | 33.4 | 54.4 |
查看答案和解析>>
科目: 来源: 题型:多选题
| X | Y | ||
| W | Z | ||
| T |
| A. | X位于元素周期表中第二周期ⅤA族 | |
| B. | Y、Z形成氢化物的沸点更高是Z | |
| C. | 由X、Y和氢三种元素形成的化合物中只有共价键 | |
| D. | 元素T与X的原子序数相差25 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 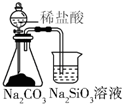 用此图可比较氯、碳、硅三种元素的非金属性强弱 | |
| B. | 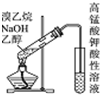 用此图检验溴乙烷与NaOH的醇溶液共热产生的乙烯 | |
| C. |  根据此图装置中U型管液面现象,证明装置漏气 | |
| D. | 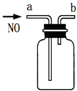 用此图装置收集一瓶纯净的NO |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com