
科目: 来源: 题型:选择题
| A. | SiO2既可与NaOH溶液反应也可与HF溶液反应,所以SiO2属于两性氧化物 | |
| B. | SO2溶于水后,其水溶液可以导电,所以SO2属于电解质 | |
| C. | 当光束照射云、烟、雾时,均可看到明显的光路,是因为三者都属于胶体 | |
| D. | 14CO2和12CO2具有相同的元素组成,所以14CO2、12CO2属于同素异形体 |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 能使甲基橙显红色的溶液中大量存在:Mg2+、Na+、Cl-、F- | |
| B. | 标准状况下,46gNO2和N2O4混合气体中含有原子个数为3NA | |
| C. | 1L0.5mol•L-1 CuSO4溶液中含有0.5NA个Cu2+ | |
| D. | 浓度均为0.1 mol/L的氨水和盐酸、由水电离出的c(H+):盐酸>氨水 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 乙烯使溴水或酸性高锰酸钾溶液褪色均属于加成反应 | |
| B. | 常温常压下环癸五烯 是一种易溶于水的无色气体 是一种易溶于水的无色气体 | |
| C. | 用酸性重铬酸钾溶液检验酒驾,发生的反应属于乙醇的氧化反应 | |
| D. | 等质量的乙烯和乙醇完全燃烧,消耗O2的物质的量相同 |
查看答案和解析>>
科目: 来源: 题型:解答题
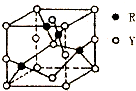 X、Y、Z、R为前四周期元素,原子序数依次增大.X、Y同周期,X基态原子的最外层电子数是次外层的2倍,Y基态原子的s能级和p能级上电子数相等;Z是地壳中含量最高的金属元素; R+离子的3d轨道全充满.请回答下列问题:
X、Y、Z、R为前四周期元素,原子序数依次增大.X、Y同周期,X基态原子的最外层电子数是次外层的2倍,Y基态原子的s能级和p能级上电子数相等;Z是地壳中含量最高的金属元素; R+离子的3d轨道全充满.请回答下列问题:查看答案和解析>>
科目: 来源: 题型:选择题
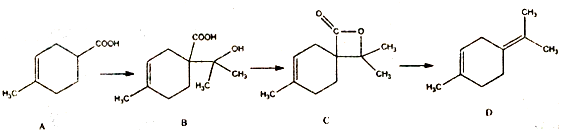
| A. | 1mol有机物B分别于足量的Na和Na2CO3溶液反应,分别生成lmolH2 和lmolCO2 | |
| B. | 有机物B的分子式为C11H18O3,它能发生取代、加成和消去反应 | |
| C. | 有机物c所有同分异构体中不可能有芳香族化合物存在 | |
| D. | 有机物D分子中所有碳原子一定共面 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题

| A. | 每生成2分子AB吸收bkJ热量 | |
| B. | 该反应中反应物的总能量高于生成物的总能量 | |
| C. | 断裂1molA-A键和1molB-B键,放出a kJ能量 | |
| D. | 该反应焓变为△H=+(a-b) kJ/mol |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 0.1mol的白磷(P4)或甲烷中所含的共价键数均为0.4NA | |
| B. | 标准状况下,一定量的铜与硝酸反应后生成22.4 L NO、NO2、N2O4的混合气体,则被还原的硝酸的分子数大于NA | |
| C. | 铁做电极电解食盐水,若阴极得到NA个电子,则阳极产生11.2L气体(标准状况下) | |
| D. | 标准状况下,2.24L Cl2通入足量H2O或NaOH溶液中转移的电子数均为0.1NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com