
科目: 来源: 题型:填空题
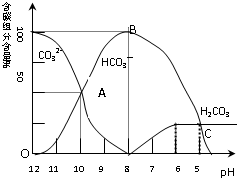 常温下在20mL0.1mol/L碳酸钠溶液中逐滴加入0.1mol/L盐酸40mL,溶液的pH逐渐降低,此时溶液中含碳元素的微粒的百分含量也发生变化(二氧化碳因为逸出未画出).据此回答下列问题:
常温下在20mL0.1mol/L碳酸钠溶液中逐滴加入0.1mol/L盐酸40mL,溶液的pH逐渐降低,此时溶液中含碳元素的微粒的百分含量也发生变化(二氧化碳因为逸出未画出).据此回答下列问题:查看答案和解析>>
科目: 来源: 题型:解答题
 “低碳生活”不只是一种理想,更是一种值得期待的新的生活方式.
“低碳生活”不只是一种理想,更是一种值得期待的新的生活方式.| 温度/℃ | 1000 | 1150 | 1300 |
| 平衡常数 | 64.0 | 50.7 | 42.9 |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:填空题
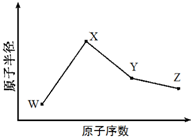 W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的原子半径在同周期主族元素中最小.
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的原子半径在同周期主族元素中最小.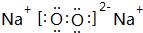 (写化学式);Z的气态氢化物和溴化氢相比,较稳定的是HCl(写化学式).
(写化学式);Z的气态氢化物和溴化氢相比,较稳定的是HCl(写化学式). .
.查看答案和解析>>
科目: 来源: 题型:填空题
 共价键都有键能之说,键能是指拆开1mol共价键所需要吸收的能量或形成1mol共价键所放出的能量.
共价键都有键能之说,键能是指拆开1mol共价键所需要吸收的能量或形成1mol共价键所放出的能量.| 化学键 | H-H | H-F | H-Cl | H-Br |
| 键能/kJ/mol | 436 | 565 | 431 | 368 |
查看答案和解析>>
科目: 来源: 题型:填空题
 D.CH3-CH2-CH2-CH3和
D.CH3-CH2-CH2-CH3和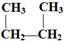 E.液氯和氯气 F.CO(NH2)2和NH4CNOG.C60和金刚石
E.液氯和氯气 F.CO(NH2)2和NH4CNOG.C60和金刚石查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 该产物的名称是1,1-二甲基丙烷 | |
| B. | 1mol加成产物燃烧消耗6.5mol氧气 | |
| C. | 原单烯烃只可能有3种不同结构 | |
| D. | 原烯烃与分子式是C3H6的烃一定互为同系物 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 6个碳原子都在一条直线上 | B. | 有可能5个碳原子在一条直线上 | ||
| C. | 6个碳原子都在同一平面上 | D. | 6个碳原子不可能在同一平面上 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 符合通式CnH2n+2的均属于烷烃 | B. | 丙烷分子中所有原子共平面 | ||
| C. | 丁烷的一氯代物有5种 | D. | 以上说法均不正确 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 常温下,7.8g固体Na2O2中,含有的阴阳离子总数为0.4NA | |
| B. | 4℃时,18g 2H216O中含有共用电子对数为2NA | |
| C. | 1 mol N5+含有的电子数为34NA | |
| D. | 用金属铁、Cu片、稀硫酸组成原电池,当金属铁质量减轻5.6g时,流过外电路的电子为0.3NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com