
科目: 来源: 题型:选择题
| 元素代号 | L | M | Q | R | T |
| 原子半径/pm | 160 | 143 | 112 | 104 | 66 |
| 主要化合价 | +2 | +3 | +2 | +6、+4、-2 | -2 |
| A. | 与稀盐酸反应的剧烈程度:L单质<Q单质 | |
| B. | 热稳定性:H2T<H2R | |
| C. | M与T形成的化合物具有两性 | |
| D. | L2+与R2-的核外电子数相等 |
查看答案和解析>>
科目: 来源: 题型:多选题
| 选项 | 实验事实 | 理论解释 |
| A | HCl气体溶于水,能导电 | HCl为离子化合物 |
| B | HBr的酸性强于HCl的酸性 | Br的非金属性比Cl强 |
| C | K3C60在熔融状态下能够导电 | K3C60中含有离子键 |
| D | HF的沸点高于HCl | HF分子间形成有氢键 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 非金属性比硫强 | B. | 原子序数为34 | ||
| C. | 氢化物比HBr稳定 | D. | 最高价氧化物的水化物显碱性 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 由非金属元素组成的化合物不一定是共价化合物 | |
| B. | 非极性键只存在于双原子分子中 | |
| C. | 构成单质分子的微粒一定含有共价键 | |
| D. | 不同元素组成的多原子分子里的化学键一定是极性键 |
查看答案和解析>>
科目: 来源: 题型:解答题
 氧(O)、硫(S)、硒(Se)、碲(Te)为ⅥA族元素,请回答下列问题:
氧(O)、硫(S)、硒(Se)、碲(Te)为ⅥA族元素,请回答下列问题: 的沸点比
的沸点比 高,原因是对羟基苯甲醛分子间能形成氢键、邻羟基苯甲醛分子内能形成氢键.
高,原因是对羟基苯甲醛分子间能形成氢键、邻羟基苯甲醛分子内能形成氢键.查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
 ,B是同周期第一电离能最小的元素,C的最外层有三个未成对电子,E的外围电子排布式为3d64s2.回答下列问题:
,B是同周期第一电离能最小的元素,C的最外层有三个未成对电子,E的外围电子排布式为3d64s2.回答下列问题: ,这样排布遵循了能量最低、泡利原理和洪特规则.
,这样排布遵循了能量最低、泡利原理和洪特规则.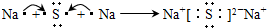 .
.查看答案和解析>>
科目: 来源: 题型:解答题
| 元素代号 | I1 | I2 | I3 | I4 |
| Q | 2080 | 4000 | 6100 | 9400 |
| R | 500 | 4600 | 6900 | 9500 |
| S | 740 | 1500 | 7700 | 10500 |
| T | 580 | 1800 | 2700 | 11600 |
| U | 420 | 3100 | 4400 | 5900 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com