
科目: 来源: 题型:选择题
| A. | 降低温度可以加快反应速率 | |
| B. | 达到化学反应限度时,生成2mol NH3 | |
| C. | 1mol N2 和3mol H2的总能量低于2mol NH3的总能量 | |
| D. | 向容器中再加入N2可加快正反应速率 |
查看答案和解析>>
科目: 来源: 题型:选择题
 ,B、C可形成离子化合物B3C2.下列说法错误的是( )
,B、C可形成离子化合物B3C2.下列说法错误的是( )| A. | A元素在元素周期表中位于第三周期第IVA族 | |
| B. | B3C2中既含离子键又含共价键 | |
| C. | B的离子半径比C的离子半径小 | |
| D. | C的氢化物可与D的最高价氧化物的水化物反应生成盐 |
查看答案和解析>>
科目: 来源: 题型:解答题
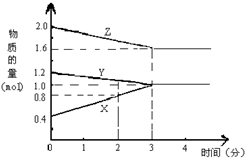 某温度时,在2L密闭容器中,X、Y、Z三种气态物质的物质的量随时间变化的曲线如图所示.由图中数据分析:
某温度时,在2L密闭容器中,X、Y、Z三种气态物质的物质的量随时间变化的曲线如图所示.由图中数据分析:查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 1mol NH3中含有3NA个N-H键 | |
| B. | 36g C60含分子数为0.05NA | |
| C. | 标准状况下,11.2L CO2中含有2NA个共用电子对 | |
| D. | 18g重水(${\;}_{1}^{2}$H2O)中含有10NA个电子 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 还原性X-强于Y2- | |
| B. | X的含氧酸的酸性比Y的含氧酸的酸性强 | |
| C. | X的单质X2能将Y的阴离子Y2-氧化,并发生置换反应 | |
| D. | X的氢化物比Y的氢化物沸点高 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 1mol碳正离子(CH3+)所含的电子总数为8NA | |
| B. | 1mol甲基(-CH3)所含的电子总数为9NA | |
| C. | 0.5mol 1,3-丁二烯分子中含有碳碳双键数为NA | |
| D. | 标准状况下,1L庚烷完全燃烧所生成的气态产物的分子数为$\frac{7}{22.4}$NN |
查看答案和解析>>
科目: 来源: 题型:解答题
 三氯氧磷(POCl3)常温下为无色液体,有广泛应用.近年来,三氯氧磷的工业生产由三氯化磷的“氧气直接氧化法”代替传统的三氯化磷“氯化水解法”(由氯气、三氯化磷和水为原料反应得到).
三氯氧磷(POCl3)常温下为无色液体,有广泛应用.近年来,三氯氧磷的工业生产由三氯化磷的“氧气直接氧化法”代替传统的三氯化磷“氯化水解法”(由氯气、三氯化磷和水为原料反应得到). AgSCN(S)+Cl-(aq);该反应使测定结果偏低;(填偏高,偏低或不变)
AgSCN(S)+Cl-(aq);该反应使测定结果偏低;(填偏高,偏低或不变)查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 正极反应式为:5MnO2+2e-═Mn5O102- | |
| B. | 每生成1 mol AgCl转移2 mol电子 | |
| C. | 工作时,电子由MnO2极经外电路流向Ag极 | |
| D. | Ag发生还原反应 |
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 加少量稀硫酸 | B. | 加热 | C. | 加蒸馏水 | D. | 加少量蓝矾 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com