
科目: 来源: 题型:解答题
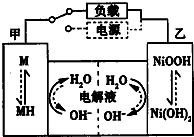 近期因“召回门”而闹得沸沸扬扬的丰田Prius属于第三代混合动力车,可以用电动机、内燃机或二者结合驱动车轮.汽车上坡或加速时,电动机提供推动力,降低了汽油的消耗;在刹车和下坡时电动机处于充电状态.
近期因“召回门”而闹得沸沸扬扬的丰田Prius属于第三代混合动力车,可以用电动机、内燃机或二者结合驱动车轮.汽车上坡或加速时,电动机提供推动力,降低了汽油的消耗;在刹车和下坡时电动机处于充电状态.查看答案和解析>>
科目: 来源: 题型:解答题
 在一容积为2L的密闭容器内加入0.2mol的N2和0.6mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g)?2NH3(g)△H<0反应中NH3的物质的量浓度的变化的情况如图:
在一容积为2L的密闭容器内加入0.2mol的N2和0.6mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g)?2NH3(g)△H<0反应中NH3的物质的量浓度的变化的情况如图:查看答案和解析>>
科目: 来源: 题型:解答题
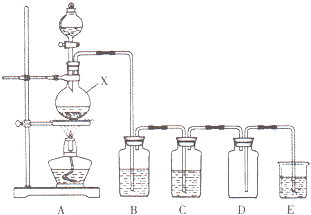 实验室中常用二氧化锰与浓盐酸共热制取氯气.某化学兴趣小组为制取较为纯净、干燥的氯气,设计了如下实验装置.
实验室中常用二氧化锰与浓盐酸共热制取氯气.某化学兴趣小组为制取较为纯净、干燥的氯气,设计了如下实验装置.查看答案和解析>>
科目: 来源: 题型:解答题
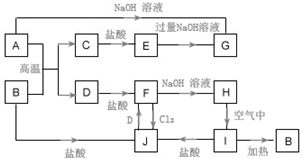 A~J为中学化学的常见物质,它们之间有如图所示的转化关系(部分产物已略去).已知A、D为金属单质,B为红棕色粉末,I为红褐色固体.
A~J为中学化学的常见物质,它们之间有如图所示的转化关系(部分产物已略去).已知A、D为金属单质,B为红棕色粉末,I为红褐色固体.查看答案和解析>>
科目: 来源: 题型:解答题
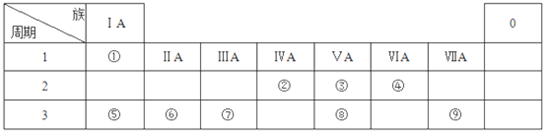
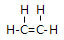 ;由④和⑥两种元素组成的化合物的电子式为
;由④和⑥两种元素组成的化合物的电子式为 ;元素⑨的原子结构示意图为
;元素⑨的原子结构示意图为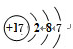 .
.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 18gH2O所含的电子数目为9N0 | |
| B. | 0.1 mol/L Na2SO4溶液所含Na+数目为0.2N0 | |
| C. | 1 mol钠完全反应时所失去的电子数为N0 | |
| D. | 标准状况下22.4L O2所含的原子数目为N0 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 称取8.0gCuSO4,加入500mL水 | |
| B. | 称取7.68gCuSO4,加入480mL水 | |
| C. | 称取12.5gCuSO4•5H2O,加水配成500mL溶液 | |
| D. | 称取12.0gCuSO4•5H2O,加水配成480mL溶液 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 铁红常用作红色油漆和涂料 | |
| B. | 明矾可用作净水剂 | |
| C. | 氯气可用于制造漂白粉 | |
| D. | 氧化钠常用作呼吸面具中氧气的来源 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 用分液漏斗分离水和乙醇的混合物 | |
| B. | 可用湿润的淀粉碘化钾试纸检验氯气 | |
| C. | 用氢氧化钠溶液除去二氧化碳气体中的氯化氢 | |
| D. | 某溶液焰色反应的火焰呈黄色,说明该溶液中只含有钠离子不含钾离子 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 电解法、热还原法、热分解法 | B. | 热还原法、热分解法、电解法 | ||
| C. | 热分解法、热还原法、电解法 | D. | 电解法、热分解法、热还原法 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com