
科目: 来源: 题型:选择题
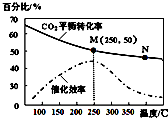
| A. | 生成乙烯的速率:v(M)有可能小于v(N) | |
| B. | 平衡常数:KM>KN | |
| C. | 当温度高于250℃,升高温度,平衡向逆反应方向移动,从而使催化剂的催化效率降低 | |
| D. | 若投料比n(H2):n(CO2)=3:1,则图中M点时,乙烯的体积分数为7.7% |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 按系统命名法,化合物CH3CH(CH2CH3)2名称3-甲基戊烷 | |
| B. | 用新制的Cu(OH)2悬浊液可以鉴别乙酸、乙醇和葡萄糖 | |
| C. | 有机物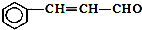 可发生加成反应、氧化反应、还原反应和聚合反应 可发生加成反应、氧化反应、还原反应和聚合反应 | |
| D. | 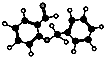 图所示的有机物分子式为C14H12O2,不能发生银镜反应 图所示的有机物分子式为C14H12O2,不能发生银镜反应 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 比较去锈的铁钉和去锈的绕有细铜丝的铁钉与同浓度的盐酸反应速率快慢时,可以加K3[Fe(CN)6]溶液,观察铁钉周围出现蓝色沉淀的快慢 | |
| B. | 将在空气中灼烧呈黑色的铜丝趁热插入盛有乙醇的试管中,铜丝变红色;反复数次,试管中的液体出现刺激性气味,表明乙醇已被铜氧化为乙醛 | |
| C. | 欲粗略测定某未知浓度的醋酸溶液中醋酸的电离常数Ka,应做的实验和所需的试剂(或试纸)为:中和滴定实验、pH试纸 | |
| D. | 从海带中提取碘,可将灰化后的海带加入水中煮沸一段时间后过滤,向滤液中滴入几滴硫酸,再加入适量H2O2溶液氧化,最后加入CCl4萃取分离 |
查看答案和解析>>
科目: 来源: 题型:填空题
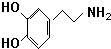 )是人体大脑中的一种有机物质叫做多巴胺.
)是人体大脑中的一种有机物质叫做多巴胺.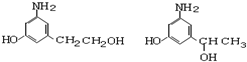 .
. 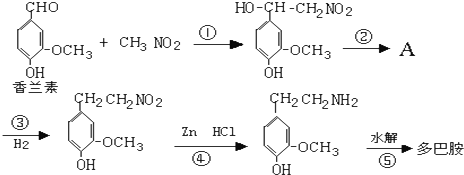
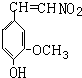 .
.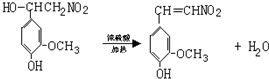 ,⑤:
,⑤: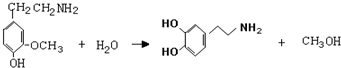 .
.查看答案和解析>>
科目: 来源: 题型:解答题

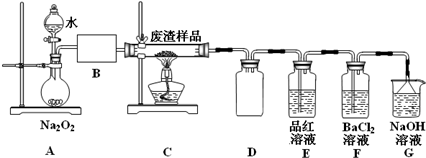
| 滴定次数 | 1 | 2 | 3 | 4 |
| KMnO4溶液体积/mL | 20.90 | 20.02 | 19.98 | 20.00 |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:解答题

| 催化剂组分质量分数(%) | CuO | 0 | 25 | 50 | 75 | 100 |
| ZnO | 100 | 75 | 50 | 25 | 0 | |
| 到达平衡所需时间(h) | 2.5 | 7.4 | 8.1 | 12 | 无催化活性 | |
查看答案和解析>>
科目: 来源: 题型:解答题
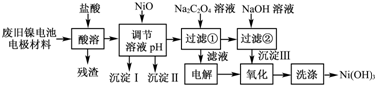
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Na+、Mg2+、Al3+的氧化性依次减弱 | B. | RbOH、KOH、Mg(OH)2的碱性依次减弱 | ||
| C. | H2S、H2O、HF的稳定性依次增强 | D. | H4SiO4、H2SO4、HClO4酸性依次增强 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com