
科目: 来源: 题型:选择题
| A. | 碱性:KOH>NaOH | B. | 元素的金属性:Mg>Al | ||
| C. | 酸性:HClO4>H2SO4 | D. | 相对分子质量:Ar>K |
查看答案和解析>>
科目: 来源: 题型:选择题
| 实验操作 | 实验目的 | |
| A | 将卤代烃加入到热NaOH溶液中一段时间后,取上层液体,加入AgNO3液产生沉淀 | 证明卤代烃中含有卤元素 |
| B | 向丙烯醛(CH2=CH-CHO)中加入足量新制银氨溶液后,滴入KMnO4(H+)溶液,观察紫色褪去 | 证明结构中存在碳碳双键 |
| C | 淀粉在硫酸催化作用下水解,将新制氢氧化铜悬浊液加入到水解后的溶液中 | 检验淀粉水解的产物葡萄糖 |
| D | 向纯碱中滴加醋酸,将产生的气体先通入饱和碳酸氢钠溶液再通入苯酚钠浓溶液 | 证明酸性:醋酸>碳酸>苯酚 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | CH3Cl不存在同分异构体 | B. | CH2Cl2不存在同分异构体 | ||
| C. | CHCl3不存在同分异构体 | D. | CCl4不存在同分异构体 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Na与水反应时增大水的用量 | |
| B. | Fe与稀硫酸反应制取氢气时,改用浓硫酸 | |
| C. | 将锌与稀硫酸反应时,向溶液中加入少量CuSO4 晶体 | |
| D. | 用碳还原Fe2O3冶炼铁时,增大碳的用量 |
查看答案和解析>>
科目: 来源: 题型:解答题
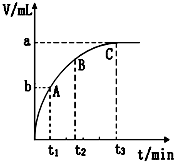 某课外兴趣小组对H2O2的分解速率做了如下实验探究.
某课外兴趣小组对H2O2的分解速率做了如下实验探究.| 30%H2O2 | 15%H2O2 | 10%H2O2 | 5%H2O2 | |
| 无催化剂、不加热 | 几乎不反应 | 几乎不反应 | 几乎不反应 | 几乎不反应 |
| 无催化剂、加热 | 360 | 480 | 540 | 720 |
| MnO2催化剂、加热 | 10 | 25 | 60 | 120 |
查看答案和解析>>
科目: 来源: 题型:解答题
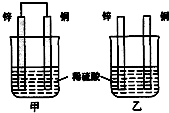 (1)已知:△H>0为吸热反应、△H<0为放热反应.实事证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是C.
(1)已知:△H>0为吸热反应、△H<0为放热反应.实事证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是C.查看答案和解析>>
科目: 来源: 题型:解答题
 .
.查看答案和解析>>
科目: 来源: 题型:选择题
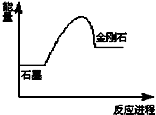
| A. | 该反应为放热反应 | B. | 金刚石比石墨稳定 | ||
| C. | 石墨比金刚石稳定 | D. | 该反应为氧化还原反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com