
科目: 来源: 题型:选择题
| A. | 0.1mol•L-1CH3COONa溶液中:H+、Ca2+、Cl-、NO3- | |
| B. | 中性溶液中:Fe3+、Na+、Br-、SO42- | |
| C. | 在含有苯酚的溶液中:K+、NH4+、Br-、Fe3+ | |
| D. | 澄清透明的溶液中:K+、Al3+、SO42-、MnO4- |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. |  灼烧 | B. |  过滤 | ||
| C. |  分液 | D. |  蒸馏 |
查看答案和解析>>
科目: 来源: 题型:解答题
 .实验室制取并检验气体A的方法是2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O,将湿润的红色石蕊试纸靠近气体,若试纸变蓝,则是氨气.
.实验室制取并检验气体A的方法是2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O,将湿润的红色石蕊试纸靠近气体,若试纸变蓝,则是氨气.查看答案和解析>>
科目: 来源: 题型:选择题

| A. | 向该溶液中加入Mg有H2逸出 | |
| B. | 向该溶液中加入少量FeCl2,其离子反应方程式为:2NO3-+6I-+4H2O | |
| C. | 该溶液还可能大量存在MnO4-、ClO- | |
| D. | 向该溶液中逐滴加入Na2CO3溶液至过量,既有气体逸出又有沉淀生成 |
查看答案和解析>>
科目: 来源: 题型:选择题
 短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,下列判断正确的是( )
短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,下列判断正确的是( )| A. | W的氢化物沸点高于水的沸点 | |
| B. | Q与氢形成的化合物一定含极性键,可能含有非极性键 | |
| C. | R的最高正价氧化物的水化物是弱电解质 | |
| D. | T与W的化合物可通过T、W的简单离子的水溶液混合制取 |
查看答案和解析>>
科目: 来源: 题型:解答题

| 物理量 | 样品质量/g | … | ||
| 实 验 | a | … |
查看答案和解析>>
科目: 来源: 题型:解答题
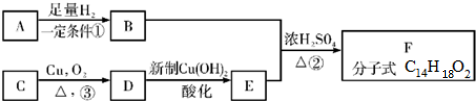
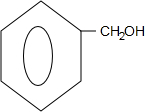 .
. +O2$→_{△}^{Cu}$
+O2$→_{△}^{Cu}$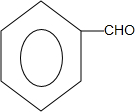 +2H2O;
+2H2O;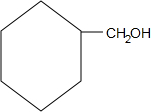 +
+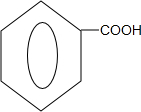 $?_{△}^{浓硫酸}$
$?_{△}^{浓硫酸}$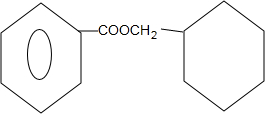 +H2O.
+H2O.查看答案和解析>>
科目: 来源: 题型:选择题
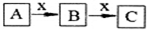 A、B、C、x均为中学化学常见物质,且A、B、C含有同一种元素,在一定条件下发生如图所示的化学变化.则x不可能是( )
A、B、C、x均为中学化学常见物质,且A、B、C含有同一种元素,在一定条件下发生如图所示的化学变化.则x不可能是( )| A. | C | B. | Al | C. | Fe | D. | O2 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
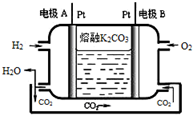 Ⅰ.短周期元素X、Y、Z、W在元素周期表中相对位置如图所示,其中Y所处的周期序数与族序数相等.按要求回答下列问题:
Ⅰ.短周期元素X、Y、Z、W在元素周期表中相对位置如图所示,其中Y所处的周期序数与族序数相等.按要求回答下列问题: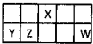
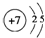 .
.| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com