
科目: 来源: 题型:解答题
 某化学兴趣小组同学利用侯德榜制碱法的原理制得了一些纯碱,经检验,样品中含有少量NH4Cl.现欲用实验测定样品的纯度,设计了多种探究方案:
某化学兴趣小组同学利用侯德榜制碱法的原理制得了一些纯碱,经检验,样品中含有少量NH4Cl.现欲用实验测定样品的纯度,设计了多种探究方案:查看答案和解析>>
科目: 来源: 题型:解答题
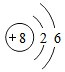 .
.查看答案和解析>>
科目: 来源: 题型:选择题
| ① | ② | ③ | ④ | |
| 溶液 | 氨水 | 氢氧化钠 | 醋酸 | 盐酸 |
| pH | 11 | 11 | 3 | 3 |
| A. | 在①中加入NH4Cl晶体,则溶液中$\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$增大 | |
| B. | 分别在等体积的②、④两溶液加水稀释100倍,所得溶液中水电离出的c(H+)相等 | |
| C. | ①、④两溶液等体积混合,所得溶液中c(Cl-)>c(NH4+)>c(OH-)>c(H+) | |
| D. | ②、③两溶液混合,若所得溶液的pH=7,则c(CH3COO-)>c(Na+) |
查看答案和解析>>
科目: 来源: 题型:选择题
| 操作和现象 | 结论 | |
| A | 向NaCl溶液中先滴加少量AgNO3溶液,后滴加少量NaI溶液,先有白色沉淀,后变成黄色沉淀 | 说明Ksp(AgI)<Ksp(AgCl) |
| B | 将SO2通入酸性KMnO4溶液中,紫色褪去 | 说明SO2具有漂白性 |
| C | 向FeCl3和CuCl2混合溶液中加入铁粉,有红色固体析出 | 说明氧化性:Cu2+>Fe3+ |
| D | 向某溶液中先滴加硝酸酸化,再滴加BaCl2溶液,有白色沉淀生成 | 该溶液中一定含有Ag+ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 常温常压下,0.1mol D216O中含中子数、质子数、电子数均为NA | |
| B. | 比黄金还贵的18O2和普通的16O2是两种不同的核素 | |
| C. | 标准状况下,2.24LCl2溶于水,转移的电子数目为0.1NA | |
| D. | 1L2mol•L-1的Al(NO3)3溶液中含Al3+个数为2NA |
查看答案和解析>>
科目: 来源: 题型:选择题
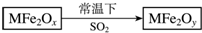 新型纳米材料MFe2Ox(3<x<4)中M表示+2价的金属元素,在反应中化合价不发生变化.常温下,MFe2Ox能使工业废气中的SO2转化为S,流程如图,则下列判断正确的是( )
新型纳米材料MFe2Ox(3<x<4)中M表示+2价的金属元素,在反应中化合价不发生变化.常温下,MFe2Ox能使工业废气中的SO2转化为S,流程如图,则下列判断正确的是( )| A. | MFe2Ox是氧化剂 | B. | SO2是该反应的催化剂 | ||
| C. | x<y | D. | MFe2Oy是还原产物 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 绿色化学的核心是利用化学原理从源头上减少和消除化学工业生产对环境的污染 | |
| B. | 对废旧电池进行回收处理主要是为了防止重金属污染水源和土壤 | |
| C. | 采用催化转换技术将汽车尾气中的NOx和CO转化为无毒气体 | |
| D. | PM2.5是指大气中直径接近于2.5×10-6m的细颗粒物,它们分散在空气中形成的混合物具有丁达尔效应 |
查看答案和解析>>
科目: 来源: 题型:填空题
 =2Cr(OH)3↓+3O2↑+2H2O
=2Cr(OH)3↓+3O2↑+2H2O查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:填空题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com