
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:填空题
 (1)反应A+3B?2C+2D在四种不同情况下的反应速率分别如下:
(1)反应A+3B?2C+2D在四种不同情况下的反应速率分别如下:查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | +92.3 kJ•mol-1 | B. | -92.3 kJ•mol-1 | C. | -184.6 kJ•mol-1 | D. | +184.6 kJ•mol-1 |
查看答案和解析>>
科目: 来源: 题型:解答题
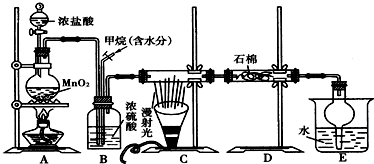
查看答案和解析>>
科目: 来源: 题型:解答题
 (1)现有如下两个反应:①NaOH+HCl=NaCl+H2O,②Fe+H2SO4=FeSO4+H2↑.
(1)现有如下两个反应:①NaOH+HCl=NaCl+H2O,②Fe+H2SO4=FeSO4+H2↑.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 放热反应均是自发反应 | |
| B. | 物质的量增加的反应,△S为正值 | |
| C. | 如果△H和△S均为正值,当温度升高时,反应可能自发进行 | |
| D. | △S为正值的反应均是自发反应 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 通入甲烷的电极为正极 | |
| B. | 电池工作一段时间后,溶液的碱性增强 | |
| C. | 负极的电极反应:CH4+l0OH--8e-=CO32-+7H2O | |
| D. | 通入甲烷的电极的电极反应:O2+2H2O+4e-=4OH- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com