
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 通入N2 | B. | 扩大容器容积 | C. | 移去部分NH3 | D. | 降低体系温度 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ①②③④ | B. | ②⑤⑥⑦ | C. | ①③④⑤⑥ | D. | 除①②外 |
查看答案和解析>>
科目: 来源: 题型:解答题
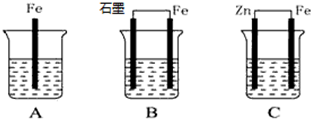
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 砷元素的最高化合价为+3 | |
| B. | 砷的气态氢化物比NH3稳定 | |
| C. | 砷的最高价氧化物的水溶液呈强碱性 | |
| D. | 砷原子的第3电子层含有18个电子 |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 构成原电池正极和负极的材料必须是两种金属 | |
| B. | 由铜、锌作电极与硫酸铜溶液构成的原电池中铜作负极 | |
| C. | 电子由外导线从锌流向铜,进入硫酸溶液后被H+得到而释放出H2 | |
| D. | 铜锌原电池工作时,若电路中通过0.4 mole-,锌片质量将减少13g |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 只有①③ | B. | 只有②③④ | C. | 只有①③④⑤ | D. | 全部 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 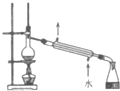 如图装置:可用于分离石油,分别得到汽油、煤油和柴油等各种纯净物 | |
| B. | 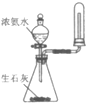 用如图装置可制取并收集干燥纯净的NH3 | |
| C. |  如图装置:如果“a进b出”可用于收集NO2,如果“b进a出”可用于收集NH3 | |
| D. |  如图装置:持续通入CO2气体,现象是先出现白色沉淀,后变澄清 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 聚2-甲基-1,3-丁二烯的结构简式: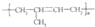 | B. | 间羟基苯甲酸的结构简式: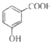 | ||
| C. | N3-的结构示意图: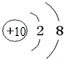 | D. | 氯化钡的电子式: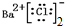 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com