
科目: 来源: 题型:多选题
| A. | 反应过程中,若降低压强能提高SiCl4的转化率 | |
| B. | 若反应开始时SiCl4为1 mol,则平衡时,吸收热量为QkJ | |
| C. | 将反应的温度由T1升高至T2,则反应的平衡常数K1>K2 | |
| D. | 当反应吸收热量为0.25QkJ时,生成的HCl恰好能与1 molNaOH反应 |
查看答案和解析>>
科目: 来源: 题型:多选题
| 选项 | 实验事实 | 解释或结论 |
| A | 2N2O5(g)?4NO2(g)+O2(g)△H>0 在室温下能自发进行 | 这是一个熵增的反应 |
| B | 向0.1mol•L-1的氨水中通入少量氨气,溶液的pH减小 | 电离平衡向逆方向移动,溶液中的c(OH-) 减小 |
| C | 锌与稀硫酸反应过程中,开始反应后速率逐渐增大 | 该反应是放热反应 |
| D | 已建立平衡的某可逆反应,当改变条件使化学平衡向正反应方向移动 | 反应物的浓度一定降低 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | △H3=0.33 kJ•mol-1 | |
| B. | 单斜硫转化为正交硫的反应是吸热反应 | |
| C. | 正交硫比单斜硫稳定 | |
| D. | 单斜硫比正交硫稳定 |
查看答案和解析>>
科目: 来源: 题型:选择题
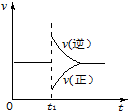 可逆反应2SO2(g)+O2(g)═2SO3(g)△H<0一定条件下在某密闭容器中达到平衡.t1时改变某一条件,化学反应速率与反应时间关系如图.下列说法中正确的是( )
可逆反应2SO2(g)+O2(g)═2SO3(g)△H<0一定条件下在某密闭容器中达到平衡.t1时改变某一条件,化学反应速率与反应时间关系如图.下列说法中正确的是( )| A. | t1时改变某一条件,平衡将向逆反应方向移动 | |
| B. | 维持压强不变,t1时升高反应体系温度 | |
| C. | 维持温度不变,t1时扩大反应体系体积 | |
| D. | 维持温度、压强不变,t1时充入SO2(g) |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 常温下,某溶液中由水电离出的c(H+)=10-5 mol•L-1,则此溶液可能是盐酸 | |
| B. | pH相等的①NH4Cl ②(NH4)2SO4 ③NH4HSO4溶液,NH4+大小顺序为:①>②>③ | |
| C. | 0.2 mol•L-1 CH3COOH溶液与0.1 mol•L-1 NaOH溶液等体积混合: c(H+)-c(OH-)=c(CH3COO-)-c(CH3COOH) | |
| D. | 0.1 mol•L-1 NaHCO3溶液中:c(Na+)+c(H+)+c(H2CO3)>c(HCO3-)+c(CO32-)+c(OH-) |
查看答案和解析>>
科目: 来源: 题型:选择题
| 序号 | 实验内容 | 实验目的 |
| A | 用石墨电极电解Mg(NO3)2、Pb( NO3)2 的混合液 | 比较确定铅和镁的金属活动性强弱 |
| B | 测相同温度下饱和Na2CO3溶液和饱和Na2SiO3溶液的pH | 确定碳和硅两元素非金属性强弱 |
| C | 室温下,用pH计测定浓度为0.1mol•L-1NaClO溶液和0.1mol•L-1CH3COONa溶液的pH | 比较HClO和CH3COOH的酸性强弱 |
| D | 室温下,分别向2支试管中加入相同体积、相同浓度的Na2S2O3溶液,再分别加入相同体积不同浓度的稀硫酸 | 研究浓度对反应速率的影响 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | IA和VIIA族元素间可形成共价化合物 | |
| B. | 第二周期:从左到右最高价从+1到+7 | |
| C. | 同主族的单核阴离子:还原性越强,水解程度越大 | |
| D. | 同周期金属:原子失电子能力越强,最高化合价越高 |
查看答案和解析>>
科目: 来源: 题型:解答题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅤⅡA | 0 |
| 2 | ⑥ | ⑦ | ||||||
| 3 | ① | ③ | ⑤ | ⑧ | ⑩ | |||
| 4 | ② | ④ | ⑨ |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com