
科目: 来源: 题型:解答题
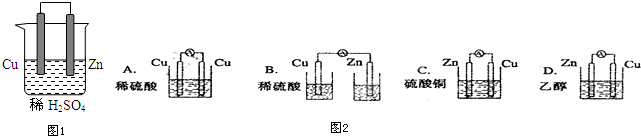
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 标准状况下,11.2LO2参加反应转移的电子数一定为2NA | |
| B. | 用双氧水分解制取0.1mol氧气,转移的电子总数为0.4×6.02×1023 | |
| C. | 0.1molAlCl3完全水解转化为氢氧化铝胶体,生成0.1NA个胶粒 | |
| D. | 28gN2和CO的混合气体中含有的分子数为NA |
查看答案和解析>>
科目: 来源: 题型:解答题
| 装 置 | 现 象 |
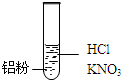 | Ⅰ.实验初始,未见明显现象 Ⅱ.过一会儿,出现气泡,液面上方呈浅棕色 Ⅲ.试管变热,溶液沸腾 |
| 实 验 | 内 容 | 现 象 |
| 实验1 | 将湿润KI-淀粉试纸置于空气中 | 未变蓝 |
| 实验2 | 用湿润KI-淀粉试纸检验浅棕色气体 | 试纸变蓝 |
| 装置 | 现象 |
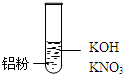 | Ⅰ.实验初始,未见明显现象 Ⅱ.过一会儿,出现气泡,有刺激性气味 |
查看答案和解析>>
科目: 来源: 题型:解答题
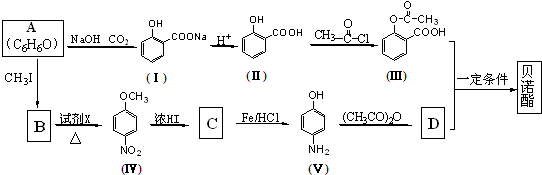
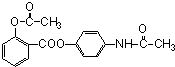
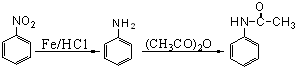
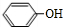 ;
;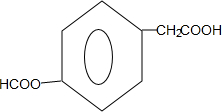 或
或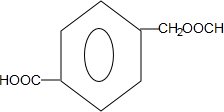 ;
;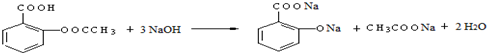 ;
; .
.查看答案和解析>>
科目: 来源: 题型:解答题
| C、O、Si第一电离能 | 离子半径Cl-、Na+、O2- | 熔点 | 电负性 |
| Si<C<O | Cl->O2->Na+ | CO2<SiO2 | Cl>Si |
查看答案和解析>>
科目: 来源: 题型:选择题
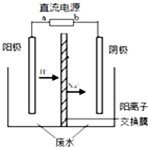 最近有研究人员发现了一种处理高浓度乙醛废水的新方法-隔膜电解法,乙醛分别在阴、阳极发生反应,转化为乙醇和乙酸.实验室以一定浓度的乙醛-Na2SO4溶液为电解质溶液,模拟乙醛废水的处理过程,其装置如图所示.下列说法正确的是( )
最近有研究人员发现了一种处理高浓度乙醛废水的新方法-隔膜电解法,乙醛分别在阴、阳极发生反应,转化为乙醇和乙酸.实验室以一定浓度的乙醛-Na2SO4溶液为电解质溶液,模拟乙醛废水的处理过程,其装置如图所示.下列说法正确的是( )| A. | 若以CH4-空气燃料电池为直流电源,燃料电池的b极应通入空气 | |
| B. | 电解过程中,生成0.1 mol乙酸的同时,有0.2 mol的乙醇生成 | |
| C. | 阳极反应CH3CHO-2e-+OH-═CH3COOH+H+ | |
| D. | 电解过程中两极除分别生成乙酸和乙醇外,均产生了无色气体,则阳极产生的是O2 |
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 两种溶液中由水电离出来的c(H+)不相同 | |
| B. | 中和相同体积的两种酸溶液所需NaOH的物质的量相同 | |
| C. | 分别用燕馏水稀释m倍和n倍,若两溶液pH仍相同,则m<n | |
| D. | 将两溶液等体积混合,则c(H+)>c(CH3COO-)═c(Cl-)>c(OH-) |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | pH=0的溶液中:K+、ClO-、CH3CHO、SO42- | |
| B. | c(H+)=10-12mol•L-1的溶液中:Na+、NH4+、Cl-、Br- | |
| C. | 加人KSCN显血红色的溶液中:Br-、NO3-、SO42-、Mg2+ | |
| D. | 在加入Al能放出大量H2的溶液中:NH4+、SO42-、C1-、HCO3- |
查看答案和解析>>
科目: 来源: 题型:选择题
| 选项 | 操作和现象 | 结论 |
| A | 向装有Fe(NO3)2溶液的试管中加入稀H2SO4,在试管口观察到红棕色气体 | 发生反应先生成NO,进而与O2反应生成NO2 |
| B | 取皂化反应的混合液滴入盛水的烧杯中,出现油滴 | 皂化反应完全 |
| C | 在溴乙烷中加入NaOH的乙醇溶液并加热,将产生的气体依次通过水、酸性KMnO4溶液,KMnO4溶液紫红色褪色 | 使KMnO4溶液褪色的气体是乙烯 |
| D | 向漂白粉溶液中通入过量的二氧化硫,溶液变浑浊 | 析出了硫酸钙 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:选择题
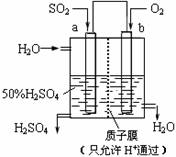
| A. | a为正极,b为负极 | |
| B. | 生产过程中a电极质量减轻 | |
| C. | 电子从b极向a极移动 | |
| D. | 负极反应式为:SO2+2H2O-2e-=SO42-+4H+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com