
科目: 来源: 题型:选择题

| A. | 实验Ⅰ:振荡后静置,上层溶液颜色保持不变 | |
| B. | 实验Ⅱ:酸性KMnO4溶液中无明显现象 | |
| C. | 实验Ⅲ:微热稀HNO3片刻,溶液中有气泡产生,广口瓶内始终保持无色 | |
| D. | 实验Ⅳ:继续煮沸溶液至红褐色,停止加热,当光束通过体系时可产生丁达尔效应 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 电池的电解液为碱性溶液,负极为Ni2O3、正极为Fe | |
| B. | 电池放电时,阴极反应为Fe+2OH--2e-═Fe(OH)2 | |
| C. | 电池充电过程中,阴极附近溶液的pH降低 | |
| D. | 电池充电时,阳极反应为2Ni(OH)2+2OH--2e-═Ni2O3+3H2O |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 加水稀释$\frac{c(O{H}^{-})}{c({H}^{+})}$增大的溶液:K+、Na+、SO42-、AlO2- | |
| B. | 常温下$\frac{{K}_{W}}{c({H}^{+})}$=0.1 mol/L的溶液:K+、Na+、SiO32-、NO3- | |
| C. | 铁片加入产生气泡的溶液:Na+、NH4+、I-、NO3- | |
| D. | NaHCO3溶液:K+、Na+、SO42-、Al3+ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 用热的纯碱溶液可洗涤餐具上的油污 | |
| B. | 新制Cu(OH)2悬浊液在医院中常用于尿糖的检测 | |
| C. | 用灼烧并闻气味的方法可区别棉麻织物和纯羊毛织物 | |
| D. | 煤经过气化和液化等物理变化可以转化为清洁燃料 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
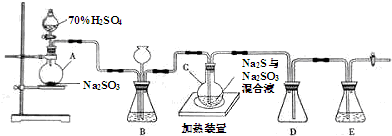
查看答案和解析>>
科目: 来源: 题型:解答题
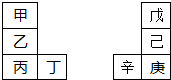 甲~辛等元素在周期表中的相对位置如图.甲与戊的原子序数相差4,戊的单质是空气中含量最多的成分,丁与辛属同周期元素,
甲~辛等元素在周期表中的相对位置如图.甲与戊的原子序数相差4,戊的单质是空气中含量最多的成分,丁与辛属同周期元素,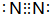 ,写出一种含戊、己两种元素的离子化合物的化学式(NH4)3PO4或(NH4)2HPO4、NH4H2PO4.
,写出一种含戊、己两种元素的离子化合物的化学式(NH4)3PO4或(NH4)2HPO4、NH4H2PO4.查看答案和解析>>
科目: 来源: 题型:解答题
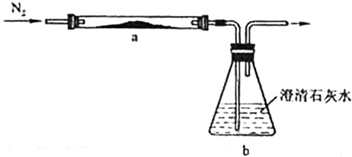
查看答案和解析>>
科目: 来源: 题型:解答题
 E的电子式为
E的电子式为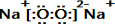 ;
;查看答案和解析>>
科目: 来源: 题型:解答题
 ;
;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com