
科目: 来源: 题型:解答题
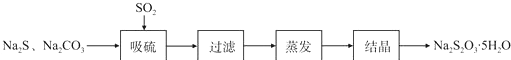
| 序号 | 实验操作 | 预期现象 | 结论 |
| ① | 取少量样品于试管中,加入适量蒸馏水,充分振荡溶解 滴加足量稀硝酸,再滴加少量AgNO3溶液,振荡 | 有白色沉淀生成 | 样品含NaCl |
| ② | 取少量样品于试管中,加入适量蒸馏水,充分振荡溶解 加入过量BaCl2溶液,搅拌,静置,用pH计测定上层清液pH | 有白色沉淀生成,上层清液pH大于9.6 | 样品含NaOH |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:填空题

查看答案和解析>>
科目: 来源: 题型:选择题
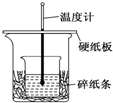 某实验小组学生用50mL 0.50mol/L的盐酸与50mL 0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量计算反应热,下列说法正确的是( )
某实验小组学生用50mL 0.50mol/L的盐酸与50mL 0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量计算反应热,下列说法正确的是( )| A. | 如图条件下实验过程中没有热量损失 | |
| B. | 图中实验装置缺少环形玻璃搅拌棒 | |
| C. | 烧杯间填满碎纸条的作用是固定小烧杯 | |
| D. | 若改用60 mL 0.50 mol/L盐酸跟50 mL 0.55 mol/L的NaOH溶液进行反应,理论上所求反应热偏高 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | PH大小顺序①>④>③>② | |
| B. | C(NH3•H2O)大小顺序:②>④>③>① | |
| C. | 混合溶液④中存在C(NH3•H2O)+C(CO32-)+C(H+)=C(OH-)+C(H2CO3) | |
| D. | 混合溶液③中水的电离被促进,其中C(H+)和C(OH-)均大于1.0×10-7mol/L |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:解答题

 ,该反应属于取代反应,有机物的名称是硝基苯.
,该反应属于取代反应,有机物的名称是硝基苯.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 元素Z的气态氢化物和最高价氧化物的水化物水溶液均呈酸性 | |
| B. | X、Y、Z三种元素组成的化合物,其化学式为Y(ZX3)3 | |
| C. | 元素Z可组成由共价键构成的单质 | |
| D. | X、Y两种元素构成一种阴离子,该阴离子与酸反应时,可能变成Y的阳离子 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 使酚酞变红色的溶液中:Na+、Al3+、SO42-、Cl- | |
| B. | $\frac{{K}_{w}}{c({H}^{+})}$=1×10-13mol•L-1的溶液中:NH4+、Ca2+、Cl-、NO3- | |
| C. | 与Al反应能放出H2的溶液中:Fe2+、K+、NO3-、SO42- | |
| D. | 水电离的c(H+)=1×10-13mol•L-1的溶液中:K+、Na+、AlO2-、CO32- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com