
科目: 来源: 题型:解答题

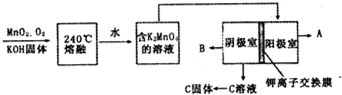
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:解答题
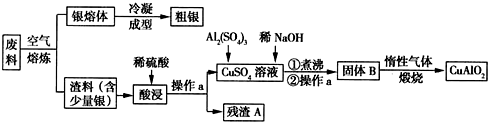
查看答案和解析>>
科目: 来源: 题型:解答题
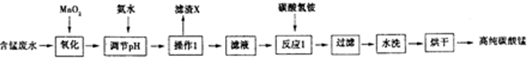
| 开始沉淀时的pH | 沉淀完全时的pH | |
| Fe3+ | 1.5 | 3.1 |
| Fe2+ | 6.5 | 9.7 |
| Al3+ | 3.3 | 5.2 |
| Mn2+ | 7.8 | 10.4 |
查看答案和解析>>
科目: 来源: 题型:解答题
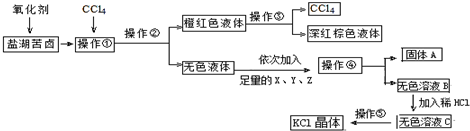
查看答案和解析>>
科目: 来源: 题型:解答题
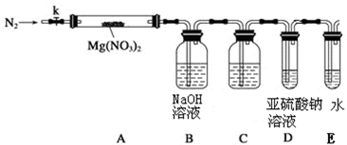 某学习小组以Mg(NO3)2为研究对象,拟通过实验初步探究硝酸盐热分解的规律.
某学习小组以Mg(NO3)2为研究对象,拟通过实验初步探究硝酸盐热分解的规律.查看答案和解析>>
科目: 来源: 题型:填空题
 乳酸亚铁晶体([CH3CH(OH)COO]2Fe•3H2O,Mr=288)是常用的补铁剂.乳酸亚铁可由乳酸与碳酸亚铁(易被空气中氧气氧化)反应制得:2CH3CH(OH)COOH+FeCO3→[CH3CH(OH)COO]2Fe+CO2↑+H2O.
乳酸亚铁晶体([CH3CH(OH)COO]2Fe•3H2O,Mr=288)是常用的补铁剂.乳酸亚铁可由乳酸与碳酸亚铁(易被空气中氧气氧化)反应制得:2CH3CH(OH)COOH+FeCO3→[CH3CH(OH)COO]2Fe+CO2↑+H2O.查看答案和解析>>
科目: 来源: 题型:解答题
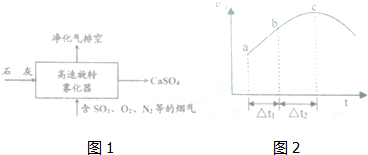
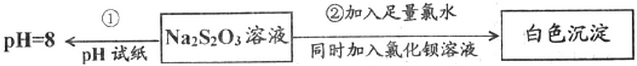
查看答案和解析>>
科目: 来源: 题型:解答题
| 化学键 | N=O | C≡O | C=O | N≡N |
| 键能(kj/mol) | 632 | 1072 | 750 | 946 |
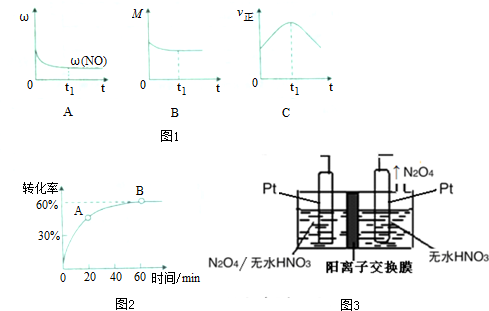
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com