
科目: 来源: 题型:解答题
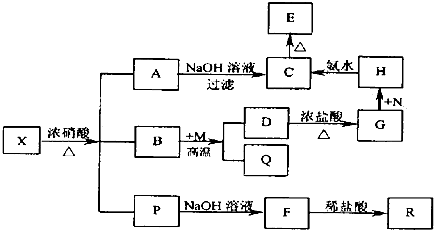
查看答案和解析>>
科目: 来源: 题型:解答题
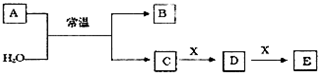
 ;
;查看答案和解析>>
科目: 来源: 题型:解答题
 有机物A是石油裂解的主要产物之一,其标准状况下的密度为1.25g/L.反应⑦能缓解目前一个重要的环境问题,生成的聚合物G(C3H4O3)n是一种可降解塑料.有关转化关系如图所示:
有机物A是石油裂解的主要产物之一,其标准状况下的密度为1.25g/L.反应⑦能缓解目前一个重要的环境问题,生成的聚合物G(C3H4O3)n是一种可降解塑料.有关转化关系如图所示: +CaCl2+2H2O.
+CaCl2+2H2O.查看答案和解析>>
科目: 来源: 题型:选择题
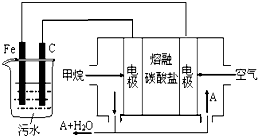
| A. | Fe为阳极,其电极反应为:Fe-3e-+3OH-=Fe(OH)3↓ | |
| B. | 通入甲烷的电极为负极,其电极反应为:CH4-8e-+10OH-=CO32-+7H2O | |
| C. | 为了使该燃料电池长时间稳定运行,电池工作时必须 有部分A物质参加循环.A物质是CO2 | |
| D. | 实验过程中,若在阴极产生了4.48 L气体,则电路中通过的电子个数为0.4NA |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 利用蓝绿藻等低等植物和微生物在阳光作用下使水分解产生氢气,该方法符合绿色化学原则 | |
| B. | 12C、13C和14C互为同位素,它们的放射性可用于考古断代,可测定生物体死亡的年代 | |
| C. | 超高分辨荧光显微镜可以观察到纳米世界,其中利用了荧光蛋白,生物发光也与荧光蛋白有关,生物发光是将化学能转化为光能的过程 | |
| D. | 分子筛中有许多笼状空穴和通道可用于分离、提纯气体,还可用作干燥剂、离子交换剂、催化剂和催化剂载体 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:填空题
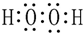
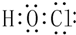
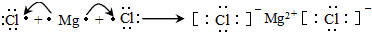
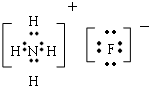
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
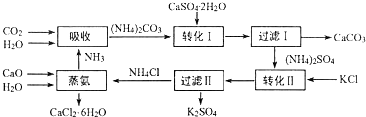
查看答案和解析>>
科目: 来源: 题型:解答题
 阿司匹林(又称乙酰水杨酸,
阿司匹林(又称乙酰水杨酸, 是世界上应用最广泛的解热、镇痛和抗炎药.乙酰水杨酸受热易分解,分解温度为128-135℃.某学习小组在实驻室以水杨酸(邻羟基苯甲酸)与乙酸酐[(CH3CO)2O]为主要原料合成阿司匹林,其制备原理为:
是世界上应用最广泛的解热、镇痛和抗炎药.乙酰水杨酸受热易分解,分解温度为128-135℃.某学习小组在实驻室以水杨酸(邻羟基苯甲酸)与乙酸酐[(CH3CO)2O]为主要原料合成阿司匹林,其制备原理为: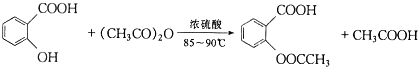
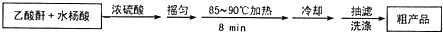

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com