
科目: 来源: 题型:解答题
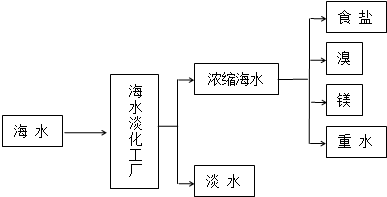
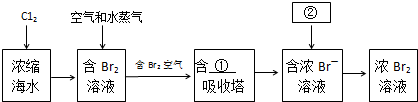
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 研制乙醇汽油(汽油中添加一定比例乙醇)技术,不能降低机动车尾气中有害气体排放 | |
| B. | 工业上用石灰乳对煤燃烧后形成的烟气进行脱硫,最终能制得石膏 | |
| C. | 为了有效的发展清洁能源,采用电解水的方法大量制备H2 | |
| D. | 世博停车场安装催化光解设施,可将汽车尾气中CO和NOx反应生成无毒气体 | |
| E. | 利用化学反应原理,设计和制造新的药物 |
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 丙烯分子中有8个σ键,1个π键 | |
| B. | 在SiO2晶体中,1个Si原子和2个O原子形成2个共价键 | |
| C. | NF3的沸点比NH3的沸点低得多,是因为NH3分子间有氢键,NF3只有范德华力 | |
| D. | NCl3和BC13分子中,中心原子都采用sp3杂化 | |
| E. | 在“冰→水→水蒸气→氧气和氢气”的变化过程中,各阶段被破坏的粒子间主要的相互作用依次是氢键、分子间作用力、极性键 |
查看答案和解析>>
科目: 来源: 题型:解答题
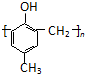 )的合成路线如下:
)的合成路线如下: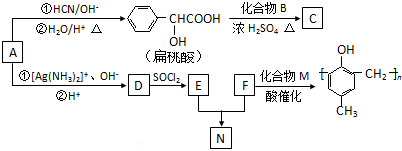
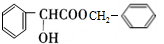 .
. .
.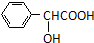 )有多种同分异构体.属于甲酸酯且含酚羟基的同分异构体有13种,写出其中一个含亚甲基(-CH2-)的同分异构体的结构简式
)有多种同分异构体.属于甲酸酯且含酚羟基的同分异构体有13种,写出其中一个含亚甲基(-CH2-)的同分异构体的结构简式 (任意一种).
(任意一种).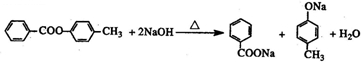 .
.查看答案和解析>>
科目: 来源: 题型:解答题
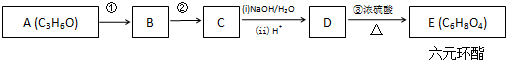
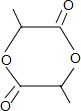 +2H2O.
+2H2O.查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
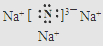 .
.查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 题述反应条件下还原性:CO>Pd | |
| B. | 题述反应中PdCl2被氧化 | |
| C. | 在标况下生成11.2 L CO2时,转移的电子为2 mo1 | |
| D. | 题述反应中CO2为氧化产物 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 采用加热分解法冶炼金属钾 | B. | 采用电解法冶炼金属铝和钠 | ||
| C. | 采用热还原法冶炼金属铁与汞 | D. | 采用热还原法冶炼金属铜与钙 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com