
科目: 来源: 题型:解答题

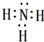 .
.查看答案和解析>>
科目: 来源: 题型:解答题
 已知:①单质E可作为半导体材料;②化合物F是不能生成盐的氧化物;③化合物I能溶于水呈酸性,它能够跟氧化物A起反应.据此,请填空:
已知:①单质E可作为半导体材料;②化合物F是不能生成盐的氧化物;③化合物I能溶于水呈酸性,它能够跟氧化物A起反应.据此,请填空:查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 0.022mol•L-1 | B. | 0.045 mol•L-1 | C. | 0.8 mol•L-1 | D. | 0.1 mol•L-1 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 78 gNa2O2晶体中所含阴阳离子个数均为2NA | |
| B. | 1.5 g CH3+中含有的电子数为NA | |
| C. | 3.4 g氨气分子中含有0.6NA个N-H键 | |
| D. | 常温下,100 mL1 mol•L-1AlCl3溶液中Al3+离子总数等于0.1NA |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 含K+为2mol的K2SO4溶液 | |
| B. | 将58.5gNaCl溶解于1L水中 | |
| C. | 将0.5mol/L的NaNO3溶液100mL加热蒸发掉50克水的溶液 | |
| D. | 将80gSO3溶于水并配成1L溶液 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 用25 mL量筒量取12.36 mL盐酸 | B. | 托盘天平称取8.75克食盐 | ||
| C. | 用酸式滴定管量取4.90mL硫酸 | D. | 用广泛pH试纸测得某溶液pH为3.5 |
查看答案和解析>>
科目: 来源: 题型:解答题
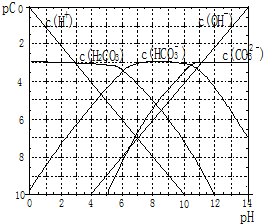 pC类似pH,是指极稀溶液中溶质物质的量浓度的常用对数负值.如某溶液溶质的浓度为:1×10-3mol/L,则该溶液中该溶质的pC=-lg1×10-3=3.已知H2CO3溶液中存在的化学平衡为:CO2+H2O?H2CO3?H++HCO3-?2H++CO32-.如图为H2CO3溶液的pC-pH图.请回答下列问题:
pC类似pH,是指极稀溶液中溶质物质的量浓度的常用对数负值.如某溶液溶质的浓度为:1×10-3mol/L,则该溶液中该溶质的pC=-lg1×10-3=3.已知H2CO3溶液中存在的化学平衡为:CO2+H2O?H2CO3?H++HCO3-?2H++CO32-.如图为H2CO3溶液的pC-pH图.请回答下列问题:查看答案和解析>>
科目: 来源: 题型:解答题
 X、Y、Z、W为含有相同电子数的分子或离子,均由原子序数小于10的元素组成,X有5个原子核.通常状况下,W为无色液体.已知:X+Y$\stackrel{△}{→}$Z+W
X、Y、Z、W为含有相同电子数的分子或离子,均由原子序数小于10的元素组成,X有5个原子核.通常状况下,W为无色液体.已知:X+Y$\stackrel{△}{→}$Z+W .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com