
科目: 来源: 题型:多选题
| A. | 0.1mol/L (NH4)2SO4溶液中:c(SO42-)<c(NH4+) | |
| B. | 相同温度下,0.6 mol/L 氨水溶液与0.3 mol/L 氨水溶液中c(OH-)之比是2:1 | |
| C. | 向0.1 mol/L NaNO3溶液中滴加稀HNO3使溶液中pH=5,则混合溶液中c(Na+)<c(NO3-) | |
| D. | 常温下向CH3COONa溶液中加入适量CH3COOH溶液,使混合液的pH=7,则混合液中c(Na+)<c(CH3COO-) |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 铁棒附近产生OH- | B. | 铁棒质量减少 | ||
| C. | 石墨棒上放出氯气 | D. | 石墨棒上放出氧气 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 都属于氧化还原反应 | B. | 生成的气体均为氧化产物 | ||
| C. | 反应物水均作氧化剂 | D. | 反应均放热 |
查看答案和解析>>
科目: 来源: 题型:解答题
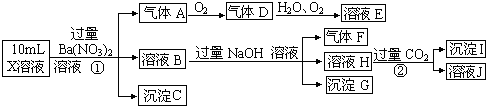
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 在反应4FeS2+11O2=2Fe2O3+8SO2中,每生成1molSO2转移电子数为5.5NA | |
| B. | 标准状况下,11.2LO2参加反应转移的电子数一定为2NA | |
| C. | t℃时,MgCO3的Ksp=4×10-6,则饱和溶液中含Mg2+数目为2×10-3NA | |
| D. | 50g46%的乙醇水溶液中,含氢原子总数目为3NA |
查看答案和解析>>
科目: 来源: 题型:选择题
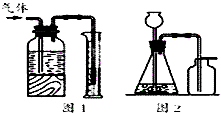
| A. | 用图1所示装置可测量产生气体的体积 | |
| B. | 用0.1000mol/L标准盐酸滴定未知浓度的氨水,用甲基橙作指示剂 | |
| C. | 用二氧化锰和浓盐酸制备少量氯气可在图2所示装置中进行 | |
| D. | 鉴别pH=8.3的NaOH溶液和pH=8.4的苯酚钠溶液,可选用广泛pH试纸检测 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
| 时间/min | CO | H2O | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | c1 | c2 | c3 | c3 |
| 4 | c1 | c2 | c3 | c3 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com