
科目: 来源: 题型:解答题
| 物质 | 熔点/℃ | 沸点/℃ |
| 1-丁醇 | -89.5 | 117.3 |
| 1-溴丁烷 | -112.4 | 101.6 |
| 丁醚 | -95.3 | 142.4 |
| 1-丁烯 | -185.3 | -6.5 |
查看答案和解析>>
科目: 来源: 题型:解答题
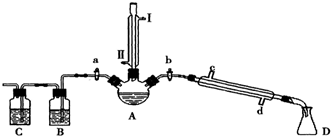
 某研究性学习小组为合成1-丁醇,查阅资料得知一条合成路线:CH2CH=CH2+CO+H2$→_{△}^{催化剂}$CH3CH3CH2CHO$→_{△}^{H_{2}催化剂}$CH3CH2CH2CH2OH.
某研究性学习小组为合成1-丁醇,查阅资料得知一条合成路线:CH2CH=CH2+CO+H2$→_{△}^{催化剂}$CH3CH3CH2CHO$→_{△}^{H_{2}催化剂}$CH3CH2CH2CH2OH.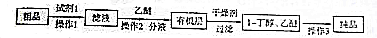
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
 NH2+CHCOOH$\stackrel{△}{?}$
NH2+CHCOOH$\stackrel{△}{?}$
 +H2O
+H2O| 名称 | 相对分子质量 | 性状 | 密度/(g/cm3) | 熔点/℃ | 沸点/℃ | 溶解度 | |
| 苯胺 | 93 | 无色油状液体具有还原性 | 1.02 | -6.1 | 184 | 微溶于水 | 均易溶于乙醇、乙醚 |
| 乙酸 | 60 | 无色液体 | 1.05 | 16.5 | 118 | 易溶于水 | |
| 乙酰 苯胺 | 135 | 白色晶体 | 1.22 | 114 | 304 | 微溶于冷水,溶于热水 | |
 ,
,查看答案和解析>>
科目: 来源: 题型:填空题
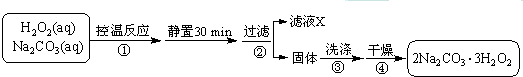
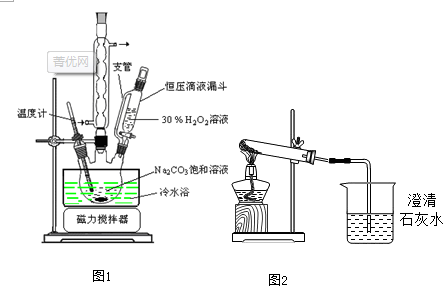
查看答案和解析>>
科目: 来源: 题型:解答题
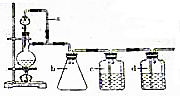
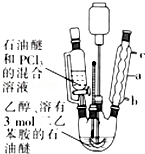 亚磷酸三乙酯[P(OC2H5)3]常用作塑料稳定剂、增塑剂,也用作医药、农药的中间体.其合成原理为PCl3+3C2H5OH$\stackrel{△}{→}$P(OC2H5)3+3HCl
亚磷酸三乙酯[P(OC2H5)3]常用作塑料稳定剂、增塑剂,也用作医药、农药的中间体.其合成原理为PCl3+3C2H5OH$\stackrel{△}{→}$P(OC2H5)3+3HCl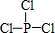 .
.查看答案和解析>>
科目: 来源: 题型:解答题
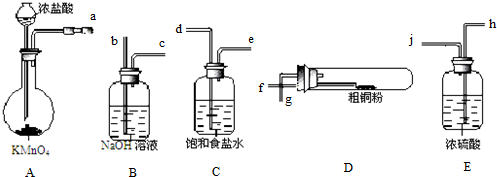
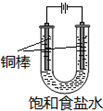 CuCl是应用广泛的有机合成催化剂,可采取不同方法制取.
CuCl是应用广泛的有机合成催化剂,可采取不同方法制取. [CuCl3]2-(无色溶液)逆向移动,生成CuCl.
[CuCl3]2-(无色溶液)逆向移动,生成CuCl.查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 比较这两种元素的单质的硬度和熔点 | |
| B. | 在氯化铝和氯化镁的溶液中分别滴加过量的氢氧化钠溶液 | |
| C. | 将打磨过的镁带和铝片分别和热水作用,并滴入酚酞溶液 | |
| D. | 将空气中放置已久的这两种元素的单质分别和热水作用 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com