
科目: 来源: 题型:解答题
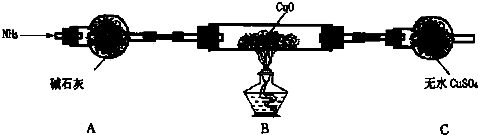
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 若a=b,pH(NaX)>pH(NaY),则相同浓度时,酸性HX<HY | |
| B. | 若a=b,并测得c(X-)=c(Y-)+c(HY),则相同浓度时,酸性HX>HY | |
| C. | 若a>b,测得c(X-)=c(Y-),则可推出溶液中c(HX)>c(HY),且相同浓度时,酸性HX<HY | |
| D. | 若两溶液等体积混合,测得c(X-)+c(Y-)+c(HX)+c(HY)=0.1mol/L,则可推出a=b=0.1 mol/L |
查看答案和解析>>
科目: 来源: 题型:解答题

| T/℃ | T1 | 300 | T2 |
| K | 1.00×107 | 2.45×105 | 1.88×103 |
查看答案和解析>>
科目: 来源: 题型:解答题
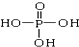 、
、 交换后的溶液用0.1mol•L-1的NaOH溶液滴定.在消耗NaOH溶液 42.00mL和50.00mL时各有一个滴定终点.请回答:
交换后的溶液用0.1mol•L-1的NaOH溶液滴定.在消耗NaOH溶液 42.00mL和50.00mL时各有一个滴定终点.请回答:查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 100mL 1mol•L-1FeCl3溶液中含阳离子数为0.1NA | |
| B. | 标准状况下,2.24L乙醛完全燃烧所得CO2分子数为0.2NA | |
| C. | 0.6gCaCO3与KHCO3的混合物中所含质子数为0.3NA | |
| D. | 80Ml 10mol•L-1浓盐酸与足量MnO2反应,转移电子数为0.4NA |
查看答案和解析>>
科目: 来源: 题型:选择题
 某温度时,AgCl(s)?Ag+(aq)+Cl-(aq)在水中的沉淀溶解平衡曲线如图所示.下列说法正确的是( )
某温度时,AgCl(s)?Ag+(aq)+Cl-(aq)在水中的沉淀溶解平衡曲线如图所示.下列说法正确的是( )| A. | 加入AgNO3,可以使溶液由c点变到d点 | |
| B. | 加入少量水,平衡右移,Cl-浓度减小 | |
| C. | d点没有AgCl沉淀生成 | |
| D. | c点对应的Ksp等于a点对应的Ksp |
查看答案和解析>>
科目: 来源: 题型:选择题
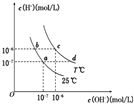 在不同温度下,水溶液中c(H+)与c(OH-)有如图所示关系.下列条件关于离子共存说法中正确的是( )
在不同温度下,水溶液中c(H+)与c(OH-)有如图所示关系.下列条件关于离子共存说法中正确的是( )| A. | a点对应的溶液中大量存在:CO32-、Na+、Cl-、SO42- | |
| B. | b点对应的溶液中大量存在:Fe2+、Ba2+、K+、NO3- | |
| C. | c点对应的溶液中大量存在:Na+、Ba2+、Cl-、Al3+ | |
| D. | d点对应的溶液中大量存在:Na+、K+、ClO-、Cl- |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | C4H10属于烷烃的同分异构体有3种 | |
| B. | 结构为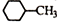 的一溴代物有5种 的一溴代物有5种 | |
| C. | 分子组成是C4H80属于醛类的同分异构体有3种 | |
| D. | 分子组成是C5H10O2属于羧酸的同分异构体有5种 |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com