
科目: 来源: 题型:多选题
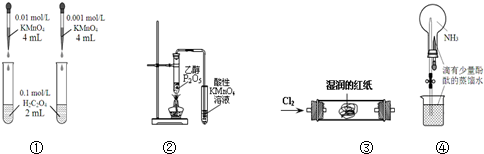
| A. | 装置①依据褪色快慢比较浓度对反应速率的影响 | |
| B. | 装置②证明CH3CH2OH发生消去反应生成了乙烯 | |
| C. | 装置③观察红纸褪色证明氯气具有漂白性 | |
| D. | 打开装置④中的止水夹,挤出胶头滴管中的液体,可观察到红色的喷泉 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 用乙醇和浓硫酸除去乙酸乙酯中的少量乙酸 | |
| B. | 用Cu与S共热制备CuS | |
| C. | 用品红和盐酸检验Na2SO3和Na2CO3 | |
| D. | 将混有乙烯的SO2通入酸性KMnO4溶液中除去乙烯 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 草木灰(含有K2CO3)水溶液可以用于洗涤油污 | |
| B. | 用海沙代替河沙作建房钢筋混凝土材料以节约成本 | |
| C. | 捕获工业排放的CO2能降低地球的温室效应 | |
| D. | 在海轮外壳上镶入锌块,可减缓船体的腐蚀速率 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 2.8g铁粉在1.12L(标准状态)氯气中充分燃烧,失去的电子数为0.15NA | |
| B. | 常温下,0.1mol/LHCl溶液中所含的H+个数为0.1NA | |
| C. | 11.2L 的CO气体与0.5molN2所含的电子数相等 | |
| D. | 10gH218O中所含的中子数为5NA |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 应用高效洁净的能源转换技术,推广使用节能环保材料 | |
| B. | 大力发展火力发电,解决电力紧张问题 | |
| C. | 研发以高纯硅为核心材料的光伏发电技术 | |
| D. | 大力开发新能源,如核能、太阳能、风能等,减少化石能源的使用 |
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 溶液中四种离子之间可能满足:c(Cl-)>c(H+)>c(NH4+)>c(OH-) | |
| B. | 若溶液中的溶质是NH4Cl和NH3•H2O,则不等式c(NH4+)>c(Cl-)>c(NH3•H2O)>c(H+)一定正确 | |
| C. | 若溶液中四种离子满足:c(Cl-)>c(NH4+)>c(H+)>c(OH-),则溶液中的溶质一定只有NH4Cl | |
| D. | 若溶液中c(Cl-)=c(NH4+),则该溶液呈中性 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 常温下,氨水与(NH4)2SO4溶液混合后pH=7的溶液中,c(NH4+):c(S042-) | |
| B. | 相同温度下,0.2 mo I•L-1乙酸溶液与0.1 mo I•L-1乙酸溶液中,c(H+)之比 | |
| C. | Na2C03溶液中,c(Na+):c(C032-) | |
| D. | 常温下,pH=12的Ba(OH)2溶液与pH=12的KOH溶液中,c[Ba(OH)2]:c(KOH) |
查看答案和解析>>
科目: 来源: 题型:填空题
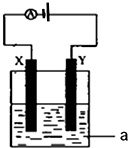 (1)事实证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是C.
(1)事实证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是C.查看答案和解析>>
科目: 来源: 题型:填空题
 CO气体还原FeO固体可以得到Fe固体,铁的化合物具有重要的应用.
CO气体还原FeO固体可以得到Fe固体,铁的化合物具有重要的应用.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com