
科目: 来源: 题型:选择题
| A. | 1 mol NaHSO4晶体中离子总数为3NA | |
| B. | 2.24L14CH4分子中所含中子数为0.8NA | |
| C. | 0.1L 3 mol•L-1的NH4NO3溶液中含有的NH4+数目为0.3 NA | |
| D. | 标况下,将FeSO4溶液置于空气中,被氧化的Fe2+为0.2 NA,吸收O2为1.12 L |
查看答案和解析>>
科目: 来源: 题型:填空题
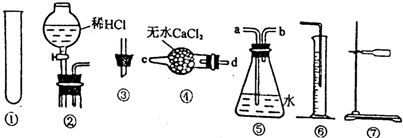
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 504 mL | B. | 168 mL | C. | 224 mL | D. | 336 ml |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 正、逆反应速率都增大,平衡不移动 | |
| B. | 正、逆反应速率都不变,平衡不移动 | |
| C. | 正、逆反应速率都增大,平衡向左移动 | |
| D. | 正、逆反应速率都增大,平衡向右移动 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | pH=1的溶液中:Na+、Fe2+、NO3-、SO42- | |
| B. | 含Fe3+的溶液中:K+、Mg2+、S2-、NO3- | |
| C. | pH=13的溶液:Na+、K+、SiO32-、NO3- | |
| D. | 强碱性溶液中:K+、Al3+、Cl-、SO42- |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | O2:二氧化锰和双氧水 带火星的木条 | |
| B. | Cl2:二氧化锰和浓盐酸 品红溶液 | |
| C. | CO2:大理石和稀硫酸 澄清石灰水 | |
| D. | NH3:NH4Cl固体和NaOH固体 湿润的红色石蕊试纸 |
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 1 mol Fe溶解于一定量的HN03溶液中,电子转移数介于2NA和3NA间 | |
| B. | L mol FeCl3完全水解转化为氢氧化铁胶体后能生成NA个Fe(OH)3胶粒 | |
| C. | 0.01 mol Mg在空气中完全燃烧生成MgO和Mg3N2,转移电子数目为0.02NA | |
| D. | 10 mL 5mol/L (NH4)2S04溶液中含有NH4+数目为0.1NA个 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 含大量OH-的溶液中:CO32-、Cl-、F-、K+ | |
| B. | 甲基橙呈黄色的溶液中;I-、Cl-、NO3-、Na+ | |
| C. | 石蕊呈蓝色的溶液中:Na+、AlO2-、NO3-、HCO3- | |
| D. | 含大量Al3+的溶液中:K+、Na+、NO3-、ClO- |
查看答案和解析>>
科目: 来源: 题型:解答题
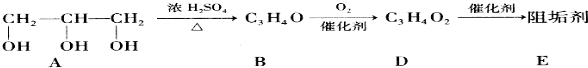
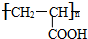 ;其反应类型为加聚反应;
;其反应类型为加聚反应;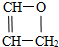 .
.查看答案和解析>>
科目: 来源: 题型:解答题
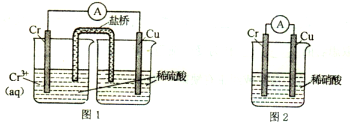
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com