
科目: 来源: 题型:解答题
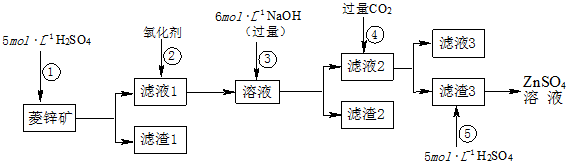
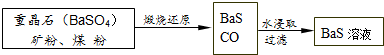
查看答案和解析>>
科目: 来源: 题型:解答题
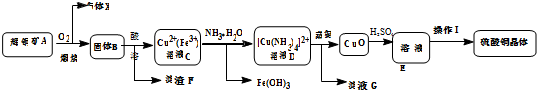
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | CH4O和C2H4O2 | B. | C8H10和C4H10 | C. | C2H4和C2H4O | D. | C8H8和C4H8O3 |
查看答案和解析>>
科目: 来源: 题型:解答题
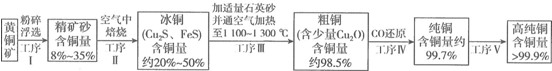
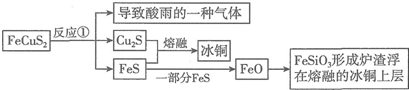
查看答案和解析>>
科目: 来源: 题型:解答题


 ,D的化学名称是丙酮.
,D的化学名称是丙酮. .
. .
. (填结构简式).
(填结构简式).查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
 茶叶中含咖啡碱,能溶于水、乙醇,更易溶于氯仿(CHCl3),178℃时快速升华.另外茶叶中还含有11%~12%的丹宁酸,也易升华,易溶于水及乙醇,但不溶于氯仿.现从茶叶中提取咖啡碱流程如下:
茶叶中含咖啡碱,能溶于水、乙醇,更易溶于氯仿(CHCl3),178℃时快速升华.另外茶叶中还含有11%~12%的丹宁酸,也易升华,易溶于水及乙醇,但不溶于氯仿.现从茶叶中提取咖啡碱流程如下:查看答案和解析>>
科目: 来源: 题型:解答题
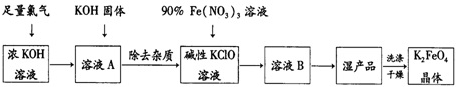
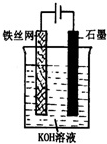
查看答案和解析>>
科目: 来源: 题型:解答题
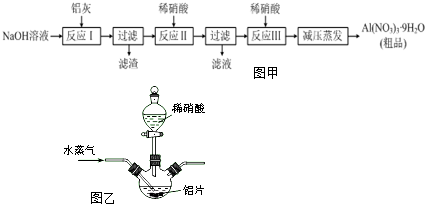
查看答案和解析>>
科目: 来源: 题型:解答题
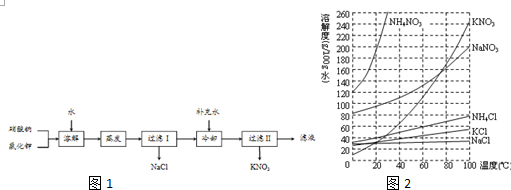
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com