
科目: 来源: 题型:解答题
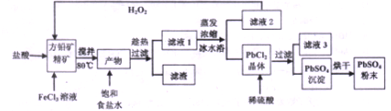
查看答案和解析>>
科目: 来源: 题型:填空题
 +Cl2$\stackrel{FeCl_{3}}{→}$
+Cl2$\stackrel{FeCl_{3}}{→}$ +HCl
+HCl| 项目 | 二氯苯 | 尾气 | 不确定苯耗 | 流失总量 |
| 苯流失量(kg/t) | 13 | 24.9 | 51.3 | 89.2 |
查看答案和解析>>
科目: 来源: 题型:填空题
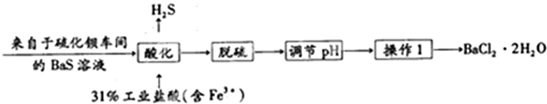
查看答案和解析>>
科目: 来源: 题型:解答题
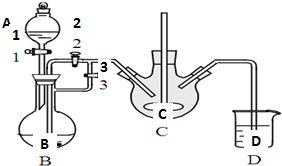 乳酸亚铁([CH3CH(OH)COO]2Fe•3H2O,Mr=288)是一种常用的补铁剂,可通过乳酸与碳酸亚铁反应制得:
乳酸亚铁([CH3CH(OH)COO]2Fe•3H2O,Mr=288)是一种常用的补铁剂,可通过乳酸与碳酸亚铁反应制得:查看答案和解析>>
科目: 来源: 题型:解答题
| 物质 | 熔点/℃ | 沸点/℃ | 化学性质 |
| Sn | 231 | 227 | 加热时与Cl2反应生成SnCl4 |
| SnCl2 | 246 | 652 | Sn2+易被Fe3+、O2等氧化 |
| SnCl4 | -33 | 114 | 极易水解 |
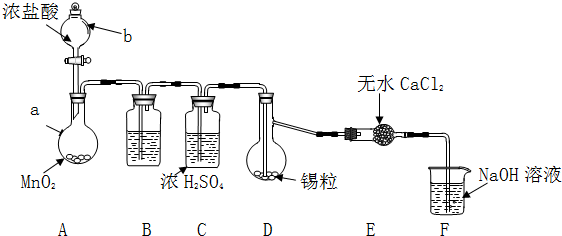
查看答案和解析>>
科目: 来源: 题型:解答题
 实验室用乙酸和正丁醇制备乙酸正丁酯.有关物质的相关数据如下表.
实验室用乙酸和正丁醇制备乙酸正丁酯.有关物质的相关数据如下表.| 化合物 | 相对分子质量 | 密度/g•cm-3 | 沸点/℃ | 溶解度/100g水 |
| 正丁醇 | 74 | 0.80 | 118.0 | 9 |
| 冰醋酸 | 60 | 1.045 | 118.1 | 互溶 |
| 乙酸正丁酯 | 116 | 0.882 | 126.1 | 0.7 |
查看答案和解析>>
科目: 来源: 题型:解答题
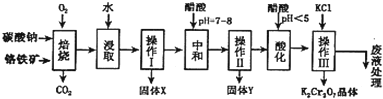
| 物质 | KCl | NaCl | K2Cr2O7 | Na2Cr2O7 | |
| 溶解度(g/100g水) | 0℃ | 28 | 35.7 | 4.7 | 163 |
| 40℃ | 40.1 | 36.4 | 26.3 | 215 | |
| 80℃ | 51.3 | 38 | 73 | 376 | |
查看答案和解析>>
科目: 来源: 题型:填空题
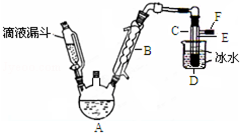 如图是实验室用乙醇与浓硫酸和溴化钠反应来制备溴乙烷的装置,反应需要加热,图中省去了加热装置.有关数据见表:
如图是实验室用乙醇与浓硫酸和溴化钠反应来制备溴乙烷的装置,反应需要加热,图中省去了加热装置.有关数据见表:| 乙醇 | 溴乙烷 | 溴 | |
| 状态 | 无色液体 | 无色液体 | 深红棕色液体 |
| 密度/g•cm-3 | 0.79 | 1.44 | 3.1 |
| 沸点/℃ | 78.5 | 38.4 | 59 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 鸡蛋清在水中形成的分散系是一种液溶胶,往其中加入饱和(NH4)2SO4溶液会生成白色沉淀 | |
| B. | 可用丁达尔效应来区分胶体和溶液 | |
| C. | 胶体中存在布朗运动,其他分散系中不存在布朗运动 | |
| D. | 某纯净纳米材料其粒子直径从几纳米到几十纳米,该纳米材料属于胶体 |
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 2.4 g 金属镁变成镁离子时失去的电子数为 0.2 NA | |
| B. | 标准状况下,18 g H2O中含有NA个水分子 | |
| C. | 常温常压下,11.2 L H2和O2的混合物所含分子个数是 0.5 NA | |
| D. | 1 mol/L NaOH溶液中含有的Na+数目是NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com