
科目: 来源: 题型:解答题
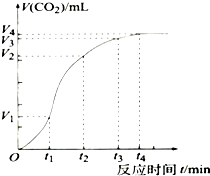 为了研究碳酸钙与稀盐酸反应的反应速率,一位同学通过实验测定反应中生成的CO2气体体积随反应时间变化的情况,绘制曲线(图).请分析讨论以下问题.
为了研究碳酸钙与稀盐酸反应的反应速率,一位同学通过实验测定反应中生成的CO2气体体积随反应时间变化的情况,绘制曲线(图).请分析讨论以下问题.查看答案和解析>>
科目: 来源: 题型:解答题
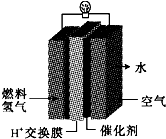 第29届奥运会期间,作为马拉松领跑车和电视拍摄车的汽车,
第29届奥运会期间,作为马拉松领跑车和电视拍摄车的汽车,查看答案和解析>>
科目: 来源: 题型:解答题
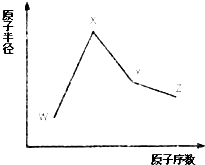 W、X、Y和Z是常见的短周期元素,其原子半径随原子序数变化如图所示.己知W的一种核素的质量数为18,中子数为10;X和Ne的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的原子半径在同周期主族元素中最小.
W、X、Y和Z是常见的短周期元素,其原子半径随原子序数变化如图所示.己知W的一种核素的质量数为18,中子数为10;X和Ne的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的原子半径在同周期主族元素中最小.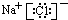 ;
;查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 酸性强弱:HClO3>H2SO3>H3PO4 | B. | 碱性:NaOH>KOH>Ca(OH)2>Mg(OH)2 | ||
| C. | 稳定性HCl>H2S>PH3 | D. | 氧化性Na+>Mg2+>Al3+ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 放出1780kJ的能量 | B. | 放出1220kJ的能量 | ||
| C. | 放出450kJ的能量 | D. | 吸收430kJ的能量 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+HCl↑ | B. | NH3+CO2+H2O═NH4HCO3 | ||
| C. | 2NaBr+Cl2═2NaCl+Br2 | D. | CuSO4+Fe═Cu+FeSO4 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 氧化亚铁加入稀硝酸:FeO+2H+=Fe2++H2O | |
| B. | 硅酸钠水溶液中通入足量的二氧化碳:SiO32-+CO2+2H2O=H2SiO3(胶体)+CO32- | |
| C. | 碳酸氢铵溶液和足量氢氧化钠溶液混合:HCO3-+OH-=CO32-+H2O | |
| D. | 铝片加入烧碱溶液:2Al+2OH-+2H2O=2AlO2-+3H2↑ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 四氯化碳的电子式: | |
| B. | 镁的原子结构示意图为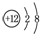 | |
| C. | 氯化氢分子的形成过程可用电子式表示为:H×+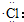 →H+[ →H+[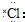 ]- ]- | |
| D. | 重水的化学式为${\;}_{1}^{2}$H2O(或D2O) |
查看答案和解析>>
科目: 来源: 题型:填空题

查看答案和解析>>
科目: 来源: 题型:填空题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com