
科目: 来源: 题型:解答题
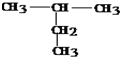 :2-甲基丁烷
:2-甲基丁烷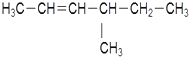 :4-甲基-2-己烯
:4-甲基-2-己烯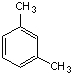 1,3-二甲苯.
1,3-二甲苯.查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:填空题
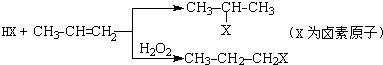
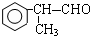 的物质,该物质是一种香料.
的物质,该物质是一种香料.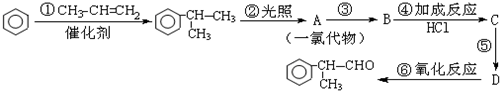
 、
、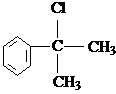 +NaOH$→_{△}^{乙醇}$
+NaOH$→_{△}^{乙醇}$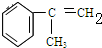 +NaCl+H2O.
+NaCl+H2O. +O2$→_{△}^{催化剂}$2
+O2$→_{△}^{催化剂}$2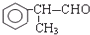 +2H2O.
+2H2O.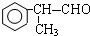 有多种同分异构体,满足下列条件:(1)苯环上一卤代物有两种,(2)属于醛类的同分异构体有4种.
有多种同分异构体,满足下列条件:(1)苯环上一卤代物有两种,(2)属于醛类的同分异构体有4种.查看答案和解析>>
科目: 来源: 题型:解答题
 Na2S2O3是重要的化工原料,易溶于水,在中性或碱性环境中稳定.
Na2S2O3是重要的化工原料,易溶于水,在中性或碱性环境中稳定.查看答案和解析>>
科目: 来源: 题型:填空题
 实验室制备硝基苯的反应原理和实验装置如下:
实验室制备硝基苯的反应原理和实验装置如下: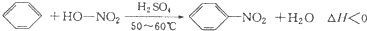
| 物质 | 熔点/℃ | 沸点/℃ | 密度/g•cm-3 | 溶解性 |
| 苯 | 5.5 | 80 | 0.88 | 微溶于水 |
| 硝基苯 | 5.7 | 210.9 | 1.205 | 难溶于水 |
| 间二硝基苯 | 89 | 301 | 1.57 | 微溶于水 |
| 浓硝酸 | 83 | 1.4 | 易溶于水 | |
| 浓硫酸 | 338 | 1.84 | 易溶于水 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | MgCl2 | B. | KCl | C. | NaNO2 | D. | MgSO4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com